
| A. | Z=0.5 mol/L | B. | Z=0.4 mol/L | ||
| C. | Y2=0.5 mol/L或X2=0.1 mol/L | D. | X2=0.2 mol/L或Y2=0.6 mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0<c(Y2)<0.6,0<c(Z)<0.4,故C正确、ABD错误;
故选:C.
点评 本题考查化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
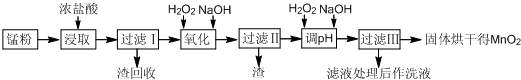
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 钠与水的反应:2Na+2H2O═2Na++OH-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 | |
| B. | KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++2SO42- | |
| C. | 利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 | |
| D. | 在FeCl3溶液中滴加NaOH溶液可得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
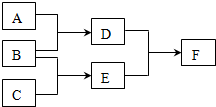 现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):
现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com