
| A. | 该溶液的pH<7 | B. | CN-的水解程度大于HCN的电离程度 | ||
| C. | c(CN-)+c(HCN)=0.02 mol•L-1 | D. | c(CN-)+c(OH-)=0.01 mol•L-1+c(H+) |
分析 A、根据阴阳离子所带电荷相等确定溶液中氢离子浓度和氢氧根离子浓度的相对大小,从而确定溶液的酸碱性;
B、根据混合溶液的酸碱性确定酸的电离程度和酸根离子水解程度的相对大小;
C、根据物料守恒确定酸根离子和酸的浓度之和;
D、根据电荷守恒确定溶液中阴阳离子关系.
解答 解:A、混合溶液呈电中性,溶液中阴阳离子所带电荷相等,因为c(Na+)>c(CN-),所以溶液中c(H+)<c(OH-),所以pH>7,故A错误;
B、混合溶液是酸和钠盐的混合液,因为c(Na+)>c(CN-),所以溶液中c(H+)<c(OH-),溶液呈碱性,说明酸的电离程度小于酸根离子的水解程度,故B正确;
C、根据溶液中物料守恒得,C(A-)+c(HA)=0.02 mol•L-1,故C正确;.
D、混合溶液呈电中性,溶液中阴阳离子所带电荷相等,n(A-)+n(OH-)=n(Na+)+n(H+),溶液中钠离子不水解,所以n(Na+)=0.01mol/L×1L=0.01mol,所以n(A-)+n(OH-)=0.01mol+n(H+),故D正确;
故选A.
点评 本题考查了弱电解质的电离,根据溶液中电荷守恒、物料守恒来分析解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 烈性炸药硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 | |
| D. | 蚊虫叮咬时释放出的蚁酸使人觉得不适,可以用肥皂水氧化蚁酸处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的大小 | B. | 能否透过滤纸或半透膜 | ||
| C. | 是否为大量分子或离子的集合法 | D. | 能否产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂 1 mol A-A 键和 1 mol B-B 键放出 x kJ 的能量 | |
| C. | 断裂 2 mol A-B 键需要吸收 y kJ 的能量 | |
| D. | 2 mol AB 的总能量大于1 mol A2 和 1 mol B2 的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.
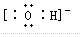 ,F粒子是
,F粒子是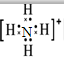 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
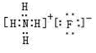 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com