
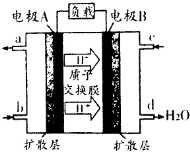
 �����ҹ���ҵ��ˮƽ�IJ��Ϸ�չ�����ˮ��������Ⱦ�����Ϊ��Ҫ���⣮
�����ҹ���ҵ��ˮƽ�IJ��Ϸ�չ�����ˮ��������Ⱦ�����Ϊ��Ҫ���⣮| [NH3?H2O] | ||
[N
|
| 5.56 |
| [NH3?H2O] | ||
[N
|
| [NH3?H2O] | ||
[N
|
| 1��10-14 |
| 1.8��10-5 |
| 1 |
| 1.8 |
| K��c(NH4+ |
|


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����a�㵽b�㣬�����Һ�����ܴ��ڣ�c��Cl-��=c��NH4+�� |
| B����ˮ�����c��H+����b�㣾c�� |
| C����ˮ�ĵ���ƽ�ⳣ����b�㣾a�� |
| D��b����c�㣬�����Һ�п��ܴ��ڣ�c��Cl-����c��H+����c��NH4+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
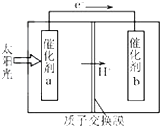 �˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϣ���ͼ��ͨ���˹���������Ʊ�HCOOH��ԭ��ʾ��ͼ������˵������ȷ���ǣ�������
�˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϣ���ͼ��ͨ���˹���������Ʊ�HCOOH��ԭ��ʾ��ͼ������˵������ȷ���ǣ�������| A������a�������Լ���������b����������ǿ |
| B������a���淢��������Ӧ����O2���� |
| C���ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ��� |
| D������b����ķ�Ӧ��CO2+2H++2e-�THCOOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
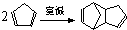 ����Ӧ����Ϊ
����Ӧ����Ϊ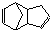 �⣬������˫�����ϩΪͬ���칹������������д������һ�ֵĽṹ��ʽ
�⣬������˫�����ϩΪͬ���칹������������д������һ�ֵĽṹ��ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
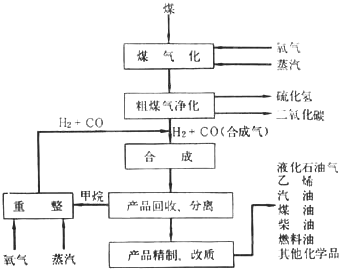
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȶ��ԣ�HCl��PH3��H2S |
| B�����ԣ�NaOH��Mg��OH��2��Al��OH��3 |
| C��ԭ�Ӱ뾶��Na��S��O |
| D�����������������CO32-��HCO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ŵ�ʱ��������ӦʽΪ3Zn-6e-+6OH-�T3Zn��OH��2 |
| B���ŵ�ʱ����������Һ��pH��С |
| C�����ʱ��ÿת��3mol���ӣ�������1mol Fe��OH��3����ԭ |
| D�����ʱ����ص�п�缫�ӵ�Դ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com