
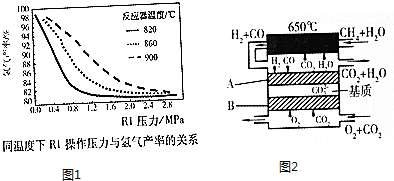
分析 Ⅰ.(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)①依据勒夏特列原理分析;
②根据可逆CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206kJ•mol-1…①、CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ•mol-1…②进行分析,应在低压反应有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备强度要求高,故选择操作压力一般控制在2.0-2.8MPa之间为宜;
Ⅱ.(3)根据盖斯定律:反应①-反应②可以得到反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H,在高温下,甲烷易分解成碳;
Ⅲ.(4)①负极上CO和H2被氧化生成二氧化碳和水;
②负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,二氧化碳有使电池稳定运行,电池的电解质组成应保持恒定作用,该电池中可循环利用的物质有
③根据电极反应式结合电子转移情况计算.
解答 解:Ⅰ.(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$,
故答案为:K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$;
(2)①升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
故答案为:升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
②反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高,故选择操作压力一般控制在2.0-2.8MPa之间为宜;
故答案为:反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高;
Ⅱ.(3)根据盖斯定律,反应CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=41KJ•mol-1+206KJ•mol-1=+247KJ•mol-1,在高温下,甲烷易分解成碳,
故答案为:+247•mol-1;CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2;
Ⅲ.(4)①负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2,
故答案为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2;
②负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,二氧化碳有使电池稳定运行,电池的电解质组成应保持恒定作用,该电池中可循环利用的物质有CO2、H2O,
故答案为:CO2、H2O.
③当1g甲烷蒸汽通入电池时,根据电极反应:CH4+4CO32--8e-=2H2O+5CO2,理论上通过导线的电子的数目为$\frac{1g}{16g/mol}$×8×6.02×1023×70%×1.6×10-19C=33712C,故答案为:33712.
点评 本题考查了化学平衡常数表达式书写、化学平衡的移动,化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等题目难度


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |

| 沉淀物 | Ksp |
| FeCO3 | 3.0×10-11 |
| MnCO3 | 2.0×10-11 |
| NiCO3 | 1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:| 化学键 | H═H | C═O | C≡O | H-O | C-H |
| F/(kJ•mol-1) | 435 | 343 | 1076 | 465 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L | |
| D. | 配制1 L 0.2 mol/L的CuSO4溶液,需用32g胆矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com