
【题目】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
A. a>b>c>d B. c>a>b>d C. a>c>d>b D. b>d>c>a
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol.L-1.min-1
B.0.2mol.L-1.min-1
C.0.3mol.L-1.min-1
D.0.6mol.L-1.min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 反应A + 3B=2C在三种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L·s)
②υ(B)=0.6mol/(L·s)
③υ(C)=0.4mol/(L·s)
该反应进行的快慢顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 。
(2)反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)请写出生成该离子的离子方程式 。
(3)x、y对应的数值范围分别是 、 。
(4)电解法获取Cu时,阴极反应式为 ,阳极反应式为 。
(5)下列关于NaClO调pH的说法正确的是 。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+![]() HClO, ClO-消耗H+,从而达到调节pH的目的
HClO, ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O![]() HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图给定的仪器组成一套实验装置(各仪器只允许用一次),在室温、 1.01×105 Pa的条件下测定镁的相对原子质量。
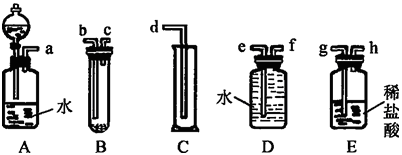
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为 (用小写字母填写)。
(2)连接好仪器后,要进行的操作有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒 C中水的体积(假定将测定的体积换算成标准状况下为 V mL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g,并将其放入试管B中);
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。
(3)根据实验数据可计算出镁的相对原子质量,其数学表达式为 。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(6)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器的规格和名称是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是( )
A. 苯不能使酸性KMnO4溶液退色,属于饱和烃
B. 常温下苯是一种易溶于水且密度比水小的液体
C. 苯不具有典型的双键,故苯不能发生加成反应
D. 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为_________,其中氮的化合价为__________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为______________。
(3)①2O2(g)+N2(g)= N2O4(l) △H1
②N2(g)+2H2(g)= N2H4(g) △H2
③O2(g)+ 2H2(g)=2H2O(g) △H3
④2 N2H4(g)+ N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=_________,联氮和N2O4可作为火箭推进剂的主要原因为__________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_________(已知:N2H4+H+="==" N2H5+的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为______________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加人联氨溶液,观察到的现象是_______________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com