
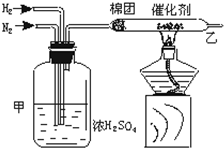
 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.分析 (1)装置甲作用:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
(2)氮气和氢气合成氨反应为可逆反应,不能进行到底,氨气为碱性气体,与水反应生成一水合氨,一水合氨显碱性,能够使红色石蕊试纸变蓝.
解答 解:(1)装置甲的三个作用:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
故答案为:干燥氮气和氢气;使氮气和氢气混合均匀;通过观察气泡控制气体比例和流速;
(2)氮气和氢气合成氨反应为可逆反应,不能进行到底,所以从乙装置出来的气体有未反应的N2、H2和生成的NH3,
氨气为碱性气体,与水反应生成一水合氨,一水合氨显碱性,能够使红色石蕊试纸变蓝,检验产物的简单化学方法:
用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气;
故答案为:N2、H2、NH3;用红色的石蕊试纸放在导气管口,如果湿润的红色石蕊试纸变蓝,则有氨气.
点评 本题考查了氨气的合成,熟悉合成氨反应的特点及装置的用途是解题关键,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S<0的反应在任何温度下都可以自发进行 | |
| B. | 蔗糖溶于水及气体扩散过程均是熵减过程 | |
| C. | △H-T△S只用于判断温度、压强一定的反应能否自发进行 | |
| D. | △H-T△S<0的反应,在该条件下一定剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
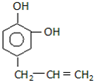 B.
B.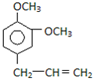 C.
C.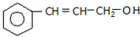
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢的五种不同粒子 | B. | 五种氢元素 | ||
| C. | 氢的五种同素异形体 | D. | 氢元素的五种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
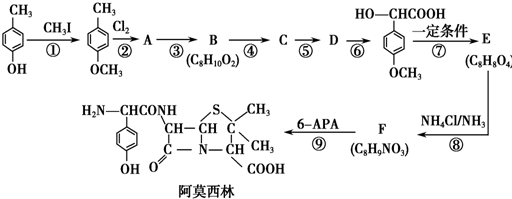
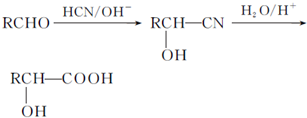

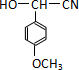 .
.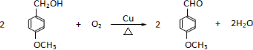 .
.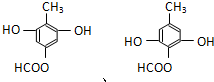 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com