
25℃时,0.1mol•L﹣1的HA溶液中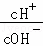 =1010,0.01mol•L﹣1的BOH溶液pH=12.请回答下列问题:
=1010,0.01mol•L﹣1的BOH溶液pH=12.请回答下列问题:
(1)HA是 (填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 .
(3)在加水稀释HA的过程中,随着水量的增加而减小的是 (填字母).
A.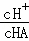 B.
B.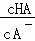 C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体 (填“多”、“少”或“相等”).
考点:
pH的简单计算;弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
(1)25℃时,0.1mol•L﹣1的某酸HA中,如果该酸是强酸,则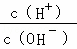 =1012,实际上则
=1012,实际上则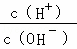 =1010,所以该酸是弱酸,弱酸中存在电离平衡;根据BOH的pH计算出溶液中的氢氧根离子浓度,然后判断电解质强弱;
=1010,所以该酸是弱酸,弱酸中存在电离平衡;根据BOH的pH计算出溶液中的氢氧根离子浓度,然后判断电解质强弱;
(2)HA为弱电解质,在溶液中部分电离,存在电离平衡;
(3)加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢氧根离子浓度增大,注意水的离子积常数只与温度有关,与溶液的酸碱性无关;
(4)等pH时,弱电解质的物质的量浓度大于盐酸的浓度,酸的物质的量越大,产生的氢气越多.
解答:
解:(1)25℃时,0.1mol•L﹣1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10﹣13mol/L,则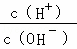 =1012>1010,所以该酸是弱酸;0.01mol•L﹣1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质,
=1012>1010,所以该酸是弱酸;0.01mol•L﹣1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质,
故答案为:弱电解质;强电解质;
(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA⇌H++A﹣,故答案为:HA⇌H++A﹣;
(3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中: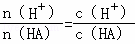 ,所以其比值增大,故A错误;
,所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则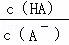 减小,故B正确;
减小,故B正确;
C.c(H+)与c(OH﹣)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故选B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多,
故答案为:多.
点评:
本题考查了弱电解质的电离平衡、溶液pH的简单计算,题目难度中等,注意掌握影响电离平衡的因素及溶液pH的计算方法,易错题是(3)题,注意加水稀释时溶液中各种微粒浓度的变化,虽然促进弱电解质电离,但加入水的量远远大于弱电解质电离的量,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②配制100mL质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后再加水至100mL刻度线
③用蒸发皿进行加热蒸发时,不必垫石棉网
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口.
|
| A. | ①④ | B. | ②④⑤ | C. | ①③ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g)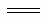 2 NO2(g) ΔH = +67.7kJ/mol
2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) 3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O
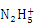 + OH-
+ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- N2 + 4H2O
N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
关于CH4和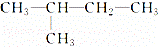 的叙述正确的是( )
的叙述正确的是( )
|
| A. | 通常情况下它们都是气态烷烃 |
|
| B. | 与所有烷烃互为同系物 |
|
| C. | 因为它们结构相似,所以它们的化学性质相似,物理性质相同 |
|
| D. | 均能用CnH2n+2组成通式来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的结构简式为: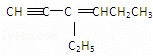 ,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
|
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
|
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2C02(g)=2CO(g)+02(g)反应的△H=+2×283.0 KJ/mol |
|
| C. | 反应A(s)+B(g)=C(s)+D(s)能自发进行,则一定有△H>0 |
|
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于指定粒子构成的叙述中,不正确的是( )
A. 37Cl与39K具有相同的中子数
B. 第114号元素的一种核素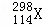 与
与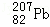 具有相同的最外层电子数
具有相同的最外层电子数
C. O22﹣与S2﹣具有相同的质子数和电子数
D. H3O+与OH﹣具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应对应的离子方程式书写正确的是( )
A. 漂白粉溶液在空气中生效:Ca2++2ClO﹣+CO2+H2O=2HClO+CaCO3↓
B. 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣
C. 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D. 0.01 mol•L﹣1NH4Al(SO4)2溶液与0.02 mol•L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3•H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com