
 下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
下列各组物质中,物质之间通过一步反应就能实现图所示转化的是| 编号 | a | b | c | d |
| ① | Na2O | Na2O2 | Na | NaOH |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| ③ | FeCl2 | FeC13 | Fe | CuCl2 |
| ④ | NO | NO2 | N2 | HNO3 |
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ①③④ |
分析 根据各组物质的化学性质及变化规律,分析各组物质间能按转化关系图完全物质间转化的一组;a→b→d→a;c→a c→b;通过列出具体的反应,可以使分析和判断变得直观、简单;
①NaOH不能通过一步反应生成氧化钠;
②铝与氧气反应得到氧化铝,与氢氧化钠反应得到偏铝酸钠,氧化铝与氢氧化钠反应得到偏铝酸钠,偏铝酸钠与酸反应得到氢氧化铝,氢氧化铝加热分解生成氧化铝.
③氯化亚铁和氯气反应一步得到氯化铁、氯化铁和铜反应生成氯化亚铁,铁和氯气反应生成氯化铁,铁和盐酸反应生成氯化亚铁;
④氮气不能一步反应得到二氧化氮.
解答 解:依据转化关系为:a→b→d→a;c→a c→b;
①NaOH不能通过一步反应生成氧化钠,故不符合;
②铝与氧气反应得到氧化铝,与氢氧化钠反应得到偏铝酸钠,氧化铝与氢氧化钠反应得到偏铝酸钠,偏铝酸钠与酸反应得到氢氧化铝,氢氧化铝加热分解生成氧化铝,Al2O3 $\stackrel{NaOH}{→}$NaAlO2$\stackrel{HCl}{→}$Al(OH)3 $\stackrel{△}{→}$Al2O3 ;Al$\stackrel{O_{2}}{→}$Al2O3 、Al$\stackrel{NaOH}{→}$NaAlO2,故符合;
③氯化亚铁和氯气反应一步得到氯化铁、氯化铁和铜反应生成氯化亚铁,铁和氯气反应生成氯化铁,铁和盐酸反应生成氯化亚铁,FeCl2$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Cu}{→}$CuCl2 $\stackrel{Fe}{→}$FeCl2;Fe$\stackrel{Cl_{2}}{→}$FeCl3、Fe$\stackrel{HCl}{→}$FeCl2,故符合;
④氮气与氧气反应得到NO,NO与氧气反应得到二氧化氮,二氧化氮与水反应得到硝酸,稀硝酸与Cu反应得到NO,但氮气不能一步反应得到二氧化氮,NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3$\stackrel{Cu}{→}$NO;N2$\stackrel{O_{2}}{→}$NO、N2不能一步转化NO2,故不符合;
故选A.
点评 本题难度较大,根据常见化学物质的性质,通过列举具体反应,判断物质间是否可以实现一步反应的转化,采用排除法(即发现一步转化不能实现,排除该选项)是解答本题的捷径.


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:解答题
 ;B的结构简式是
;B的结构简式是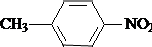 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取5.25 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH值为12.5 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 配制70mL 0.1 mol/L的稀硫酸选用100 mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c ( NH4+)+c ( Na+)=c ( Cl-)+c ( OH-) | |
| B. | c ( NH4+)+c ( NH3•H2O )=0.4mol/L | |
| C. | c ( Cl-)>c ( NH4+)>c ( Na+)>c ( OH-)>c ( H+) | |
| D. | c ( Cl-)>c ( Na+)>c ( NH4+)>c ( H+ )>c ( OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe2+与足量的H2O2溶液反应,转移2nA个 | |
| B. | 1L0.1mol•L-1的氨水含有0.1nA个OH- | |
| C. | 常温常压下,22.4LCCl4含有个nA个CCl4分子 | |
| D. | 常温下,23g NO2含有nA个氧原子电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com