
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3 |
| B、NaH2PO4、Na2HPO4 |
| C、NaHSO4、NaHCO3 |
| D、Na2SO4、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
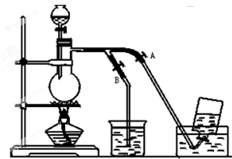 如图表示在没有通风处收集纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风处收集纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向等体积的20%的H2O2溶液和10%的H2O2溶液中分别滴加等体积的0.1mol?L-1 FeCl3溶液和0.1mol?L-1CuCl2溶液,前者产生气泡快,这个实验可以充分证明催化剂具有选择性 |
| B、不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同 |
| C、将0.1 mol?L-1醋酸加水稀释,溶液中各离子浓度均减小 |
| D、室温下同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH(醋酸)+Ca(ClO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NaIO3+Cl2 |
| D、4HCl(浓)+MnO2=△=MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应热就是反应中放出的能量 |
| B、在任何条件下,化学反应的焓变都等于化学反应的反应热 |
| C、由C(s,石墨)═C(s,金刚石)△H=+1.9kJ?mol-1可知,金刚石比石墨稳定 |
| D、等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
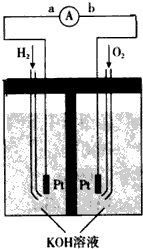 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com