
【题目】下列粒子属于等电子体的是( )
A.CH4和NH![]() B.NO和O2C.NH
B.NO和O2C.NH![]() 和H3O+D.HCl和H2O
和H3O+D.HCl和H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
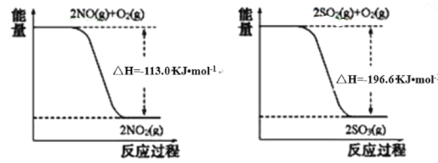
【题目】Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
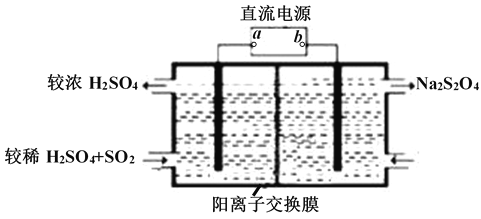
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
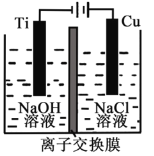
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
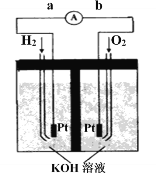
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 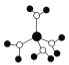 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 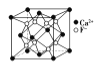 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式书写正确是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.![]()
C.CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,![]() 不变
不变
B.常温下,0.01mol·L-1Ba(OH)2溶液pH为12
C.常温下,CH3COOH稀溶液中加水稀释,则![]() 减小
减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
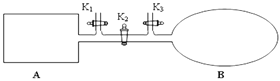
①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
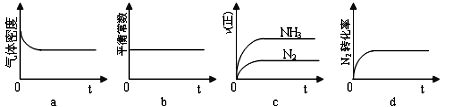
【题目】向绝热恒容密闭器中通入![]() 和
和![]() ,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率
,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率![]() 正
正![]() 随时间
随时间![]() 变化的示意图如图所示。由图可得出的正确结论是
变化的示意图如图所示。由图可得出的正确结论是
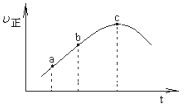
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.逆反应速率:c点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡![]() 是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
I.(查阅资料)
物质 | 熔点 | 沸点 | 化学性质 |
Sn | 231 | 227 | 加热时与 |
| 246 | 652 |
|
|
| 114 | 极易水解 |
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持和加热装置
省略夹持和加热装置![]()
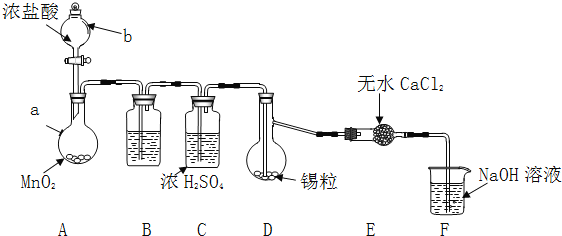
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是 ______ ,其中无水![]() 的作用是 ______ ,B中的试剂是 ______
的作用是 ______ ,B中的试剂是 ______ ![]() 选填下列字母编号
选填下列字母编号![]() 。
。
A.![]() 溶液
溶液 ![]() 溶液
溶液
![]() 饱和NaCl溶液
饱和NaCl溶液 ![]() 溶液
溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置 ______ 后![]() 填实验现象
填实验现象![]() ,再加热熔化锡粒,反应完后,停止加热。
,再加热熔化锡粒,反应完后,停止加热。
(3)待反应结束后,经 ______ ![]() 填写操作名称
填写操作名称![]() 、洗涤、干燥,可回收利用装置A中未反应完的
、洗涤、干燥,可回收利用装置A中未反应完的![]() 。
。
Ⅲ![]() 探究与反思
探究与反思![]()
(1)装置F中吸收![]() 发生反应的离子方程式是 ______ 。
发生反应的离子方程式是 ______ 。
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充 ______ ![]() 填装置名称
填装置名称![]() 。
。
(3)为验证产品中是否含有![]() ,该小组设计了以下实验方案:
,该小组设计了以下实验方案:![]() 所需试剂从稀
所需试剂从稀![]() 、稀HCl、
、稀HCl、![]() 溶液、
溶液、![]() 溶液、KSCN溶液、蒸馏水中选择
溶液、KSCN溶液、蒸馏水中选择![]()
取适量![]() 产品溶入20mL蒸馏水中,加入 ______ ,若 ______
产品溶入20mL蒸馏水中,加入 ______ ,若 ______ ![]() 填实验现象
填实验现象![]() ,则含有
,则含有![]() ,否则无
,否则无![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com