
 2Z��g��һ���ﵽ��ѧƽ��״̬���ǣ�������
2Z��g��һ���ﵽ��ѧƽ��״̬���ǣ�������| m |
| n |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��
��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��| ���� |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�õ�����(Si3N4)�մɴ���������췢���������Ȳ������ܴ������߷���������Ч�ʡ���ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)+Q(Q>0)
Si3N4(s)+12HCl(g)+Q(Q>0)
���������գ�
31����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2 L��3 min��ﵽƽ�⣬��ù��������������2.80 g����H2��ƽ����Ӧ����___ mol��(L��min)���÷�Ӧ��ƽ�ⳣ������ʽK=_____
32��������Ӧ�ﵽƽ�������˵����ȷ����_��
a�������������䣬ѹǿ����ƽ�ⳣ��K��С
b�������������䣬�¶����ߣ�ƽ�ⳣ��K��С
c�������������䣬����Si3N4���ʵ���ƽ�������ƶ�
d�������������䣬����HCl���ʵ���ƽ�������ƶ�
33��һ�������£����ܱպ��ݵ������У��ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����__��
a��3v��(N2)=v��(H2) b��v��(HCl)=4v��(SiCl4)
c����������ܶȱ��ֲ��� d��c(N2)��c(H2)��c(HCl)=1��3��6
34����ƽ��ʱH2��HCl�����ʵ���֮��Ϊ![]() �����������������䣬�����¶Ⱥ�ﵽ�µ�ƽ��ʱ��H2��HCl�����ʵ���֮��___
�����������������䣬�����¶Ⱥ�ﵽ�µ�ƽ��ʱ��H2��HCl�����ʵ���֮��___![]() ���>������=����<��)��
���>������=����<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��л�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ������
��ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��SiCl4(g)+
2H2(g)  Si
(s) + 4HCl(g) ��236kJ
Si
(s) + 4HCl(g) ��236kJ
���������գ�
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2L��H2��ƽ����Ӧ����Ϊ0.1mol/(L��min)��3min��ﵽƽ�⣬��ʱ��ù�������� g��
��2���÷�Ӧ��ƽ�ⳣ������ʽK�� ������ͨ��_______ʹK����
��3��һ�������£����ܱպ��������У��ܱ�ʾ������Ӧһ���ﵽ��ѧƽ��״̬���� ��
a��2v��(SiCl4)��v��(H2)
b���Ͽ�4molSi��Cl����ͬʱ������4molH��Cl��
c����������ܶȱ��ֲ���
d��c(SiCl4)��c(H2)��c(HCl)��1:2:4
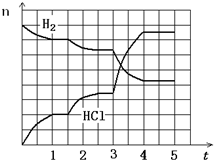
��4������Ӧ������ͼ��ʾ���������ʾ�������Ȼ�������ʵ�����mol�����������ʾʱ�䣨min������������Ӧ����û�м������ȡ�����ʣ����1.5���Ӹı��������______����3���Ӹı��������__________����ƽ��̬������ת������С��ʱ�����_____________ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com