
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)不变
C. 电池工作一段时间后,乙池溶液的总质量减小
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: ①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl ![]() SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃.
请回答:
(1)第一步制取粗硅的化学反应方程式为 .
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点﹣84.7℃),提纯SiHCl3采用的方法为 .
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去): 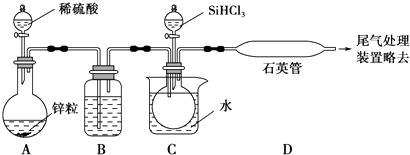
①装置B中的试剂是 , 装置C中的烧杯需要加热,目的是 .
②反应一段时间后,装置D中观察到的现象是 , 装置D不能采用普通玻璃管的原因是 , 装置D中发生反应的化学方程式是 .
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。试回答:
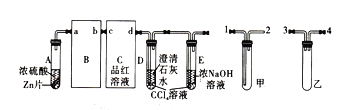
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接_____、______接b,c接_____、______接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为__________________;D、E试管中CCl4溶液的作用是__________。
(3)D中浑浊消失的离子方程式为___________________。
(4)如果锌完全溶解,共生成气体5.6L(标准状况),将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,则反应共消耗锌____g,生成气体的成分及体积之比为_______。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的___(填“氧化性”“还原性”或“漂白性”),请写出反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁屑和氯气在500~600 ℃ 下可制取无水FeCl3 ,实验装置如下图。下列说法正确的是( )

A. 分液漏斗中盛放的试剂是稀盐酸
B. 实验时应先点燃I 中酒精灯,再点燃Ⅲ中酒精灯
C. 洗气瓶中盛放的试剂是饱和食盐水
D. 烧杯中盛放的试剂是澄清石灰水,目的是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
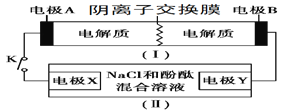
A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
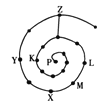
A. Y元素的氢化物的热稳定性比Z元素的氢化物差
B. K、Z两元素的氢化物的水溶液都显酸性
C. L、M、X三元素位于同一族
D. K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学现象和化学概念表述正确的是
A. 0.5molFe和含1 mol HNO3的稀溶液充分反应后,滴入KSCN溶液,溶液变红
B. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C. 含有143个中子的U(92号)原子的原子符号: ![]() U
U
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )
A.1.0mol/L
B.2.0mol/L
C.3.0mol/L
D.4.0mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com