
用下图所示装置进行实验,下列对实验现象的解释不合理的是
| ①中试剂 | ①中现象 | 解 释 | |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+ O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+ O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+ O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+ O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-2 878 kJ·mol-1 B.ΔH=-2 658 kJ·mol-1
C.ΔH=-1 746 kJ·mol-1 D.ΔH=-1 526 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读以下内容,回答问题。
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2,或CO)法;③活泼金属置换法;④电解法。四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为________(填序号)。
A.O2、CO2 B.O2、CO
C.CO2、CO D.CO、CO2
(2)下列说法错误的是________(填序号)。
A.对废旧金属最好的处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液制得
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
(3)钛(Ti)有“未来钢铁”之称,工业上常以TiCl4 +2Mg
+2Mg Ti+2MgCl2获得海绵状钛,该反应在下列哪种环境中进行________(填序号)。
Ti+2MgCl2获得海绵状钛,该反应在下列哪种环境中进行________(填序号)。
A.稀有气体中 B.空气中
C.氮气中 D.CO2气体中
查看答案和解析>>
科目:高中化学 来源: 题型:
将装有50 mL NO2和NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为
30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5 C.3∶2 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
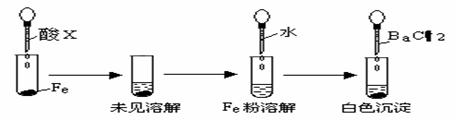
(1)下列说法错误的 。
A.将Cl2通入紫色石蕊试液,溶液先变红后褪色
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
F.实验室可以用加热氯化铵的方法制取少量氨气
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
(2)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。实验过程中需从导管a处缓缓鼓入一定量的空气。

①装置E的名称 ,试剂b为 。
②实验过程中需要测定的数据除样品质量外有: (填序号)。
A.反应前后装置C的质量 B.反应前后装置D的质量 C.反应前后装置E的质量
③若去掉装置A,则测定结果 (填“偏高”“偏低”或“无影响”)。
(3)某不纯的烧碱样品,含Na2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%。取m g样品溶于40 m L 2 mol/L的盐酸后,并用2 mol/L Na OH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为______ (选择下列正确的选项填空) A.4.68 g B.5.58 g C.2.34 g D.3.34 g
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质中可能有葡萄糖、蚁酸、甲醇、甲酸丙酯几种物质中的一种或几种,在鉴定时有下列现象:①有银镜反应 ②加入新制Cu(OH)2悬浊液,沉淀不溶解,③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,下列叙述中正确的是( )
A.一定有甲酸丙酯和蚁酸 B.一定有蚁酸和葡萄糖
C.一定有甲酸丙酯,可能有葡萄糖 D.几种物质都一定有
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列给定条件的各溶液中,一定能大量共存的离子组是( )
A.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3-
B.室温下 =10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
=10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
C.加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3-
D.在H+、Na+、SO42-浓度均为0.1 mol·L-1的溶液中:K+、SiO32-、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)  SiO2(s)+4HF(g)
SiO2(s)+4HF(g)
ΔH=+148.9 kJ·mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:_________________________________________________________________________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com