
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
 (4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(1) III (1分) CaCO3+2H+=Ca2++H2O+CO2↑(1分)
饱和NaHCO3 (1分)浓H2SO4(1分)
(2)高温或强热(1分)打开III中的止水夹(2分) 澄清的石灰水变浑浊(1分)
(3)①4Na+3CO2 2Na2CO3+C(2分)②2Na+2CO2 Na2CO3+CO(2分)
(4)生成正盐。因为根据质量守恒定律可知,反应物共有三种元素,没有氢元素,因此不能生成酸式盐。或生成正盐(1分)因为高温条件下碳酸氢钠不存在。(其它合理答案均给分)(2分)
解析:(1)装置III实验简易启普发生器,可达到实验,目的。实验室制取CO2的方程式为CaCO3+2H+=Ca2++H2O+CO2↑。由于制取的CO2中含有氯化氢和水蒸气,二者均和钠反应,需要需要在通入D之前全部除去,分别用饱和碳酸氢钠溶液和浓硫酸。
(2)装置中有酒精喷灯,说明反应需要高温。装置中含有空气,空气也能氧化钠,所以需要先利用CO2排尽装置中的空气。
(3)①F中无现象,说明没有CO生成,根据固体的性质可知,生成物是碳酸钠和碳,方程式为4Na+3CO2 2Na2CO3+C。
②根据实验现象可知,生成物是碳酸钠和CO,方程式为2Na+2CO2 Na2CO3+CO。
(4)由于在反应中没有氢元素参与,所以不可能是酸式盐,且在高温下碳酸氢钠也是不存在的。


科目:高中化学 来源: 题型:
| 空陶瓷管的质量 | 陶瓷管与钾的总质量 | 陶瓷管与产物的总质量 |
| 14.80g | 15.19g | 15.47g |

查看答案和解析>>
科目:高中化学 来源:2012届河北省冀州市中学高三联排考试化学试卷(带解析) 题型:实验题
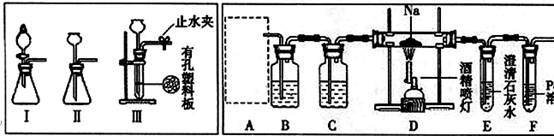
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。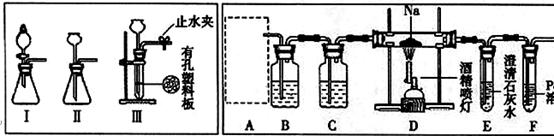
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:实验题
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置
是 (填写“I”、“II”或“III”),其离子方程式是 ,。装置B、C中应盛放的试剂分别是 。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置E 中出现 现象时,再点燃酒精喷灯。[来源:Zxxk.Com]
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
 (4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
查看答案和解析>>
科目:高中化学 来源:09-10年西南师大附中高二下期期末考试化学卷 题型:实验题
(14分) 某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
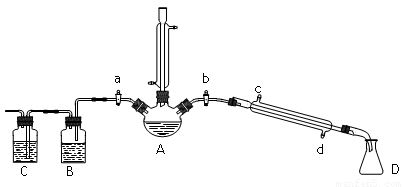
(1) 关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是_____________________。
(2) ①理论上,上述反应的副产物可能有:丁醚、________________(填结构简式)、溴化氢、硫酸氢钠、水等。
②熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是__________;___________
③有同学通过某仪器鉴定所得产物中含有“-CH2CH2CH2CH3”, 从而确定副产物中存在丁醚。该同学的观点___________(填“正确”或“错误”)原因是____________
_______________________________________。
(3) 为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
请你补充下列实验步骤,直到分离出1-溴丁烷。
|
物质 |
熔点/℃ |
沸点/℃ |
|
1–丁醇 |
– 89.5 |
117.3 |
|
1–溴丁烷 |
– 112.4 |
101.6 |
|
丁醚 |
– 95.3 |
142.4 |
|
1–丁烯 |
– 185.3 |
– 6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③______________________;
④接通冷凝管的冷凝水,使冷水从________处流入;
⑤迅速升高温度至____________℃收集所得馏分。
(4) 若实验中所取1–丁醇、NaBr分别为7.4 g、13.0 g(浓H2SO4足量),蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1–溴丁烷,则1–溴丁烷的产率是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com