
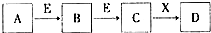 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C | |
| D. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
分析 A.A为氢氧化钠、E为二氧化碳、B为碳酸钠、C为碳酸氢钠、X为盐酸;
B.A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠;
C.若D是一种强酸,如为硝酸,则A为氮气或氨气,B为NO,C为NO2,E为O2,X为H2O.
D.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe.
解答 解:A.若D为NaCl,A为氢氧化钠、E为二氧化碳、B为碳酸钠、C为碳酸氢钠、X为盐酸,符合转化关系,故A正确;
B.若D是一种强碱,A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠,符合转化关系,Na、氧化钠、过氧化钠都能与水反应,故B正确;
C.若D是一种强酸,如为硝酸,则A为氮气或氨气,B为NO,C为NO2,E为O2,X为H2O,稀硝酸与铜反应生成NO,浓硝酸与铜反应生成NO2,故C正确;
D.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe,才能实现转化关系,故D错误.
故选D.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,熟练掌握元素化合物知识,题目难度较大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  实验室用装置制取氨气 | |
| B. |  装置X若为CCl4,可用于吸收氨气并防止倒吸 | |
| C. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| D. |  装置是原电池,铁电极为负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  制取Cl2用 制取Cl2用 | |
| B. |  可完成“喷泉”实验 可完成“喷泉”实验 | |
| C. |  制取干燥的NH3 制取干燥的NH3 | |
| D. |  分离石油,得到汽油、煤油和柴油等各种馏分 分离石油,得到汽油、煤油和柴油等各种馏分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胆矾、漂白粉、氯化钾、硫酸钡 | B. | 盐酸、空气、硝酸、干冰 | ||
| C. | 冰醋酸、海水、氧化铝、乙醇 | D. | 蛋白质、油脂、烧碱、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 | |
| D. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂用标准盐酸溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中所含阴离子的数目是0.2×6.02×1023 | |
| B. | 标准状况下,2.24L18O2中所含中子的数目是6.02×1023 | |
| C. | 1mol甲烷中含共用电子对的数目是4×6.02×1023 | |
| D. | 电解精炼铜时,当阳极溶解6.4g铜,则转移的电子数为6.02×1022个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com