
某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
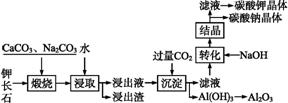
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式: 。
(2)已知NaAlO2和KAlO2易发生如下反应:Al+2H2O Al(OH)3+OH-。“浸取”时,应保持溶液呈 (填“酸”或“碱”)性。“浸取”时不断搅拌的目的是 。
Al(OH)3+OH-。“浸取”时,应保持溶液呈 (填“酸”或“碱”)性。“浸取”时不断搅拌的目的是 。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
.规范答题:(1)①CaCO3+SiO2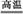 CaSiO3+CO2↑
CaSiO3+CO2↑
②Na2CO3+Al2O3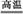 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2)碱 提高浸取速率
(3)HC+OH- H2O+C
H2O+C
(4)Na2CO3 CO2
解析:(1)利用原子守恒,结合题中信息可知反应的另一产物为CO2,因此可写出有关反应式。(2)为防止Al水解,溶液应保持碱性;搅拌的目的是加速溶解,提高浸取速率。(3)因向“浸出 液(含有偏铝酸根离子)”通入过量CO2,因此过滤出Al(OH)3沉淀后的滤液中含有大量的HC,故加入NaOH的主要作用是使HC转化为C。(4)结合流程知,在煅烧时产生的CO2与在结晶时析出的碳酸钠可循环利用。
液(含有偏铝酸根离子)”通入过量CO2,因此过滤出Al(OH)3沉淀后的滤液中含有大量的HC,故加入NaOH的主要作用是使HC转化为C。(4)结合流程知,在煅烧时产生的CO2与在结晶时析出的碳酸钠可循环利用。


科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
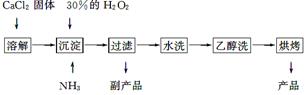
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验Ⅰ:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6 mol·L-1盐酸或6 mol·L-1硫酸,其他试剂任选)
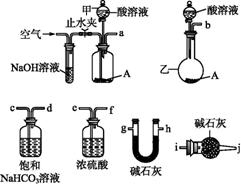
回答下列问题:
(1)仪器乙的名称为 。
(2)请选择必要的装置完成实验Ⅱ,正确的连接顺序为 (按气流方向,用接口字母表示);选用的酸溶液是 。
(3)有人提出不采用实验Ⅰ,可在实验Ⅱ结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2~3次,将洗涤液过滤,洗涤沉淀2~3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是 ,实际上 未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
A.科 学性 B.安全性
学性 B.安全性
C.可行性 D.简约性
(4)x与y的关系式是 (用等式表示)。
(5)通过实验Ⅰ的相关数据,经计算可得A的摩尔质量为602.0 g·mol-1。实验Ⅱ中称得样品A的质量为9.030 g,与足量酸完全反应后,CO2吸收装置增重0.660 g,则A的化学式为  。
。 
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
烟道气中的CO2可用于合成甲醇和甲醚。
(1)下图所示为其中的一种方法:
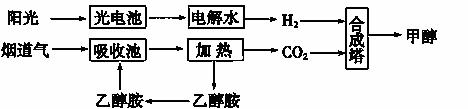
①用光电池电解水时,阳极的电极反应式为__________________________________。
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显________(填“酸”“碱”或“中”)性。
③已知,CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为
________________________________________________________________________。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)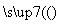 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填序号)。
a.生成1 mol CH3OCH3(g)的同时,生成3 mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1∶3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500 K | 600 K | 700 K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
上述反应的化学平衡常数的表达式为__________。该反应的焓变ΔH________0(填“>”、“<”或“=”,下同),若使a>45%,则x________1.5。
③在一定温度下,向体积为0.5 L的密闭容器中加入2 mol CO2和6 mol H2,20 min后达到平衡,测得平衡时CH3OCH3为0.5 mol,则该反应的反应速率v(CO2)=____mol·L-1·min-1,H2的转化率α(H2)=______;加入催化剂,v(CO2)________(填“增大”、“减小”或“不变”,下同),α(H2)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对有机物 命名正确的是( )
命名正确的是( )
A.5,7二甲基3乙基1辛烯
B.3乙基5,7二甲基1壬烯
C.3甲基5乙基7丙基8壬烯
D.7甲基5乙基3丙基1壬烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是关于氯水的叙述,正确的是
A.新制氯水中只含C12和HClO分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2 D.氯水放置数天后,PH值将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com