
分析 硫酸钠的物质的量不变,根据稀释定律计算混合后溶液的体积;
根据混合后硫酸的浓度,结合n=cV计算混合后n(H2SO4),进而计算加入的硫酸的物质的量,根据c=$\frac{1000ρω}{M}$计算98%的H2SO4溶液的物质的量浓度,再根据V=$\frac{n}{c}$计算需要加入的98%的H2SO4溶液的体积.
解答 解:硫酸钠的物质的量不变,根据稀释定律,设混合后溶液的体积为V,则:
200mL×0.4mol•L-1=V×0.2mol•L-1,解得:V=0.4L=400mL;
则混合后溶液中硫酸的物质的量为:n(H2SO4)=0.4L×1.2mol•L-1=0.48mol,
故加入的硫酸的物质的量为:0.48mol-0.2L×0.4mol•L-1=0.4mol,
98%的H2SO4溶液的物质的量浓度:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故需要加入98%的H2SO4溶液的体积为:$\frac{0.4mol}{18.4mol/L}$≈0.0217L=21.7mL,
答:需要加入的98%的H2SO4溶液的体积为21.7mL,加水稀释到400mL.
点评 本题考查物质的量浓度的有关计算,题目难度中等,根据硫酸钠的物质的量不变计算混合后溶液的体积是关键,注意掌握物质的量与物质的量浓度之间的关系,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
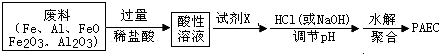
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com