
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,在水溶液中或熔融状态下能导电的化合物是电解质,据此分析解答.
解答 解:①Ne为单原子分子,不存在化学键,只存在分子间作用力;
②NH4Cl ③KNO3、⑧Na2O2中含有离子键和共价键,为离子化合物;
④NaOH中含有离子键和共价键,为离子化合物;
⑤Cl2中只含共价键,为单质;
⑥SO2⑦H2S中只含共价键,为共价化合物,但硫化氢是电解质;
⑨MgCl2中只含离子键,为离子化合物;
(1)只存在离子键的是⑨,故选⑨;
(2)只存在共价键的是⑤⑥⑦,故选⑤⑥⑦;
(3)只存在共价键的电解质是⑦,故选⑦;
(4)既存在离子键又存在共价键的是②③④⑧,故选②③④⑧;
(5)不存在化学键的是①,故选①;
(6)属于共价化合物的是⑥⑦,故选⑥⑦;
(7)属于离子化合物的是②③④⑧⑨,故选②③④⑧⑨.
点评 本题考查化学键和化合物的判断,为高频考点,侧重考查基本概念,明确物质构成微粒及微粒之间作用力是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
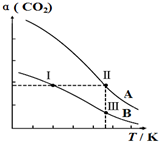 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )| A. | 反应2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)的△S<0、△H<0 | |
| B. | 表示乙容器CO2的平衡转化率随温度变化的是曲线B | |
| C. | 体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
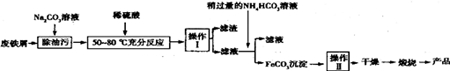
 HCO3-+OH-;
HCO3-+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

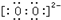
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多加煤以使炉火更旺 | B. | 把煤炭做成大煤球 | ||
| C. | 把煤中掺合一些黄泥做成蜂窝煤 | D. | 把煤粉碎,在煤粉燃烧器中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com