
| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
分析 A、HF为弱酸,不能完全电离;
B、据Ksp(CaF2)与Qc(CaF2)判断;
C、AgCl能转化为AgI;
D、根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度.
解答 解:A、HF为弱酸,不能完全电离,所以常温下O.1 mol•L-1HF溶液pH>l,故A错误;
B、向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,Qc(CaF2)=0.1×0.12=1.0×10-3>Ksp(CaF2)=1.46×10-10,有沉淀生成,故B错误;
C、AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI,故C错误;
D、已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{1.8×1{0}^{-10}}$,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}$×10-11mol/L,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,注意沉淀转化为溶解度更小的物质容易发生,题目难度不大.


科目:高中化学 来源: 题型:选择题
| a | b | c | d | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
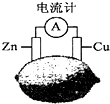
| A. | 将电能转换为化学能 | B. | 电子由铜片流出经导线到锌 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧柠檬变蓝色,产生Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | 高铁酸钾(K2FeO4)是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| D. | 测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
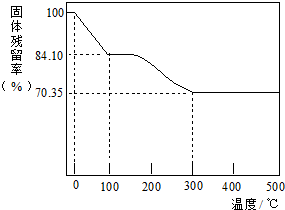
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
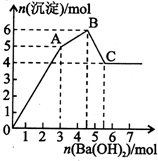 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com