
| A、滴定管 | B、容量瓶 |
| C、量筒 | D、托盘天平 |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X中肯定存在Fe2+、NH4+、SO42- |
| B、溶液E和气体F不能发生化学反应 |
| C、X中肯定不存在CO32-、SO32-、C1- |
| D、沉淀I是A1(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
A、最终得到沉淀的质量大于
| ||
B、该饱和溶液质量百分比浓度为:
| ||
| C、最终所得溶液PH不变 | ||
D、该饱和溶液中溶质物质的量浓度为:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
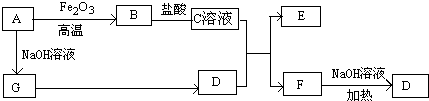
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com