
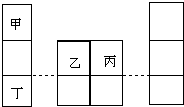
 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )| A. | 简单离子半径:r(丁)>r(乙)>r(丙) | |
| B. | 元素丙的简单气态氢化物的热稳定性比乙的强 | |
| C. | 仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性 | |
| D. | 丙和丁形成的两种化合物中阴阳离子个数比不同 |
分析 甲是原子半径最小的元素,丙原子最外层有6个电子,由短周期元素甲、乙、丙、丁在元素周期表中的相对位置,可知甲为H元素,丙为O元素,则乙为N元素、丁为Na.
A.电子层结构相同的离子,核电荷数越大离子半径越小;
B.元素非金属性越强,对应氢化物越稳定;
C.一水合氨溶液呈碱性;
D.丙和丁形成的两种化合物为Na2O、Na2O2.
解答 解:甲是原子半径最小的元素,丙原子最外层有6个电子,由短周期元素甲、乙、丙、丁在元素周期表中的相对位置,可知甲为H元素,丙为O元素,则乙为N元素、丁为Na.
A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(乙)>r(丙)>r(丁),故A错误;
B.非金属性丙>乙,故元素丙的简单气态氢化物的热稳定性比乙的强,故B正确;
C.仅由甲、乙、丙三种元素形成的化合物为硝酸、硝酸铵、一水合氨等,一水合氨溶液呈碱性,故C错误;
D.丙和丁形成的两种化合物为Na2O、Na2O2,阴阳离子个数比均为1:2,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期律表的结构与元素周期律,C选项为易错点,学生溶液忽略常见的一水合氨,难度中等.


科目:高中化学 来源: 题型:选择题
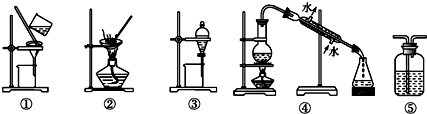
| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
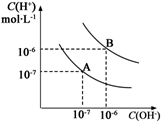 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中含有羟基 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水无法鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 苯可以使溴水褪色,是发生了加成反应 | |
| C. | 乙醛在一定条件下与氧气反应生成乙酸,乙醛发生了氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com