
分析 (1)向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,氨水分子浓度增大;
(2)硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性;
(3)根据溶液中阴阳离子所带电荷相等确定硫酸根离子浓度;
(4)氨水可以和硫酸发生反应生成硫酸铵,根据溶液总的组成情况来回答.
解答 解:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液中中c(OH-)/c(NH3•H2O)减小;
故答案为:减小;
(2)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3.H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O?NH3.H2O+H+;铵根离子水解溶液显酸性,铵根离子浓度减小,水解程度很小,所以溶液中各离子物质的量浓度由大到小的关系是c(NH4+)>c(SO42-)>c(H+)>c(OH-);
故答案为:NH3•H2O+H+=NH4++H2O,<,NH4++H2O?NH3•H2O+H+;c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(3)溶液呈中性,则溶液中c(H+)=c(OH-),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5amol/l;溶液中氢离子和氢氧根离子的浓度都很小,所以c(SO42-)>c(H+),溶液中各离子物质的量浓度由大到小的关系是c(NH4+)>c(SO42-)>c(H+)=c(OH-);
故答案为:0.5amol/l;c(NH4+)>c(SO42-)>c(H+)=c(OH-);
(4)向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液恰好为硫酸铵,溶液中铵根离子水解,溶液显示酸性,离子浓度大小关系为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查了弱电解质的电离、盐类的水、离子浓度大小的比较等知识点,题目难度中等,离子浓度大小的比较是学习的难点也是考试的热点,根据物料守恒和电荷守恒来进行分析即可,侧重于考查学生的分析能力.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
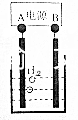 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
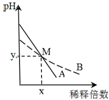 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)>10 c(B) | |
| B. | 中和等浓度等体积的盐酸时,B用的体积较多 | |
| C. | M点时A和B的浓度相等 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者产生等量的氢气 | B. | 强酸溶液产生氢气的速度快 | ||
| C. | 弱酸溶液产生较多的氢气 | D. | 无法比较两者产生氢气的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=0时:[H+]>[Cl-]=[CH3COOH] | B. | V=10 mL时:[OH-]+[CH3COO-]=[H+] | ||
| C. | V=20 mL时:[Na+]=[CH3COO-]+[Cl-] | D. | 加入NaOH溶液至pH=7时,V>20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=n+m | B. | a-b=n-m | C. | 质子数Y>X | D. | 核电荷数Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂金做首饰不能用金属键理论解释 | |
| B. | 固态和熔融时易导电,熔点在1 000℃左右的晶体可能是金属晶体 | |
| C. | Li、Na、K的熔点逐渐升高 | |
| D. | 金属导电和熔融电解质(或电解质溶液)导电的原理一样 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com