
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式__________________________________________
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应。氧化产物为__________
(3)当0.1 mol MnO2参加反应时,转移电子数为____,被氧化的HCl为________mol。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷.工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2 , 两者的体积比约为1:1.已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成液态水放出286kJ热量;1molCH4 气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出H2完全燃烧生成液态水的热化学反应方程式: , 若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为;燃烧生成的CO2 的质量比约为 .
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H = _____kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
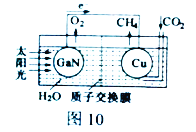
①写出铜电极表面的电极反应式_____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
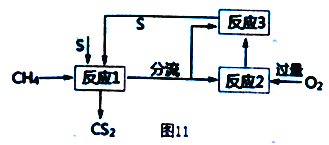
①写出发生反应1的化学反应方程式___________。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( ) 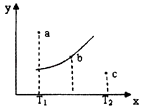
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:
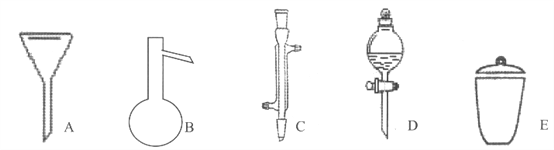
写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积硫酸铁、硫酸镁、硫酸铵溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度比为 ( )
A. 1︰3︰3 B. 3︰2︰1 C. 9︰6︰1 D. 6︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序为 ( )
①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热,用余热蒸干
A. ②③④⑤①B. ①②③④⑤C. ②③①④⑤D. ②①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com