
现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)=0.1 mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
(1)CO32- + H2O HCO3- + OH- BaCl2或CaCl2
HCO3- + OH- BaCl2或CaCl2
(2)测0.1 mol·L-1 Na2CO3溶液pH,pH≤12 (3)D、E (4)10(2a-14)
【解析】
试题分析:(1) 纯碱碳酸钠是强碱弱酸盐。在溶液中存在的水解平衡主要是CO32- + H2O HCO3- + OH-,还有HCO3- + H2O
HCO3- + OH-,还有HCO3- + H2O H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O
H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O HCO3- + OH-。c(CO32-)(始)= 0.1 mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1 Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O
HCO3- + OH-。c(CO32-)(始)= 0.1 mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1 Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O HCO3- + OH-, HCO3- + H2O
HCO3- + OH-, HCO3- + H2O H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)=0.1 mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)=0.1 mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
考点:考查盐的水解平衡、盐水解程度的测定、离子浓度的大小比较、相同pH的碱与盐的水的电离的知识。


科目:高中化学 来源:2016届吉林省高一教学评估(一)化学试卷(解析版) 题型:计算题
在50 mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)求稀释后的溶液中H+的物质的量浓度
(2)若a=9,求生成的气体中NO2的物质的量
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH溶液恰好被吸收,求需要NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.39K+和40Ca2+微粒中的电子数和中子数都相等
B.在标准状况下,若D2和He体积相等,则质量不相等
C.7.8 g Na2O2与足量的CO2反应时失去的电子数为0.2 NA
D.把1 mol NaCl溶于1 L水中,所得NaCl溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.同周期的主族元素中,ⅦA族元素的原子半径最小
B.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱
C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素
D.ⅠA元素的原子,其半径越大,越容易失去电子
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液)。下列叙述不正确的是
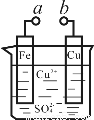
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铁片上发生的反应为:Fe-3e- = Fe3+
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
下列措施不能增大反应速率的是
A.锌与稀硫酸反应时,加少量铜粉
B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸
C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉
D.恒温时,增大H2(g)+Br2(g) ?2HBr(g)反应体系的压强
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
短周期元素中,原子基态时具有1个未成对电子的元素共有多少种( )
A.5 B.6 C.7D.8
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A.②③ B.③⑥ C.①④ D.⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com