
| A. | GeO2不溶于NaOH溶液 | B. | 单质锗具有导电性 | ||
| C. | 锗易与盐酸反应放出H2 | D. | 锗是一种重要的半导体材料 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用浓溴水区分苯和甲苯 | |
| B. | 淀粉和纤维素水解的最终产物均为果糖 | |
| C. | 实验室中,可以用电石和饱和食盐水制取乙炔 | |
| D. | H2N-CH2-COOH和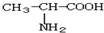 缩合只能形成一种二肽 缩合只能形成一种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
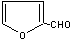 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化: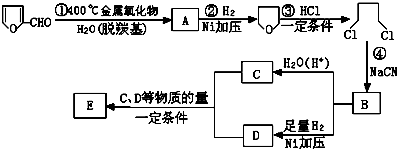
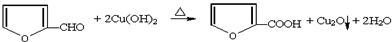 或
或 .
.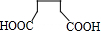 +n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$
+n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$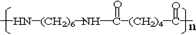 +(2n-1)H2O.
+(2n-1)H2O.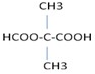 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com