
【题目】下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是__,不存在化学键的是__,离子化合物有__。
(2)由离子键和极性键构成的物质是__。
(3)N2的电子式为__,HClO的电子式为__,NH4Cl的电子式为__。
(4)用电子式表示MgF2的形成过程__。
【答案】③④⑤ ① ②⑥⑦ ⑦ ![]()
![]()
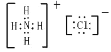
![]()
【解析】
①Ar中不含化学键;
②Na2O2为离子化合物,由钠离子和过氧根离子构成,其含有离子键和非极性共价键;
③CCl4为共价化合物,其含有极性共价键;
④HClO为共价化合物,其含有极性共价键;
⑤N2中含有非极性共价键;
⑥MgF2为离子化合物,由镁离子、氟离子构成,其含有离子键;
⑦NH4Cl为离子化合物,由铵根离子和氯离子构成,其含有极性共价键和离子键。
(1)综上分析,③④⑤只存在共价键,①Ar不存在化学键,②⑥⑦为离子化合物,故答案为:③④⑤;①;②⑥⑦;
(2)NH4Cl为离子化合物,由铵根离子和氯离子构成,铵根离子中含有极性共价键,铵根离子和氯离子间为离子键,则由离子键和极性键构成的物质是⑦NH4Cl,故答案为:⑦;
(3)N2分子中氮原子之间为氮氮三键,其电子式为![]() ;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为
;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为![]() ;NH4Cl由铵根离子和氯离子构成,其电子式为
;NH4Cl由铵根离子和氯离子构成,其电子式为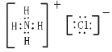 ,故答案为:
,故答案为:![]() ;
;![]() ;
;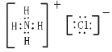 ;
;
(4)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为![]() ,故答案为:
,故答案为:![]() 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得,以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
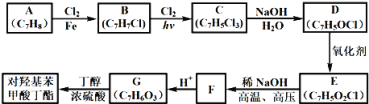
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;②D可与银氨溶液反应生成银镜;③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1﹕1。
回答下列问题:
(1)A的化学名称为________;
(2)由B生成C的化学反应方程式为_______,该反应的类型为_______;
(3)D的结构简式为________;
(4)F的分子式为_______;
(5)G的结构简式为________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有_______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2﹕2﹕1的是______(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。不考虑空间构型,[B(OH)4]-的结构可用示意图表示为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论错误的是 ( )
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向久置的Na2SO3溶液中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先出现白色沉淀,然后部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,可能有Fe3+ |
D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ΔH2
HCHO(g)+H2O(g) ΔH2
反应III:2H2(g)+O2(g)![]() 2H2O(g) ΔH3=—483.6kJ/mol
2H2O(g) ΔH3=—483.6kJ/mol
(1)计算反应Ⅱ的反应热ΔH2=__________________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______。
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______(用含有k正、k逆的式子表示)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=
CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1______X2(填“>”或“<”,后同),Q______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3和NaHCO3。
①已知25℃时0.1mol / L的NaHCO3溶液的pH=8.3,试通过计算确定溶液中各离子浓度由大到小的顺序为_____[已知:常温下H2CO3的电离常数Ka1= 4.4×107、Ka2 = 5×1011 ]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。
[已知:常温下Ksp(BaSO4)=1×107、Ksp(BaCO3)=2.5×106 ]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com