
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
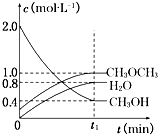
 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )| A、盐酸的浓度 |
| B、镁条的表面积 |
| C、Cl-的浓度 |
| D、溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/(L?S) |
| B、0.05mol/( L?min) |
| C、0.05mol/(L?s) |
| D、0.8mol/(L?S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12 L NO与1.12O2的混合物中含有的原子数为0.2NA |
| C、25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中氧原子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
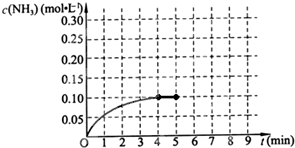 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com