

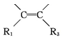
 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+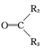
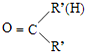 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$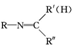 +H2O
+H2O  +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O .
.  (写出其中一种的结构简式).
(写出其中一种的结构简式).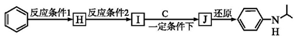 ,
, .
. 分析 A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为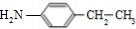 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,
,
(5)由苯与浓硝酸、浓硫酸在加热条件下得到H为硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为 ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到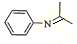 ,最后加成反应还原得到
,最后加成反应还原得到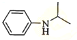 .
.
解答 解:A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,
,
(1)A发生消去反应生成B,反应方程式为C(CH3)2Cl-CH(CH3)2+NaOH$→_{△}^{乙醇}$C(CH3)2=C(CH3)2+NaCl+H2O,
故答案为:C(CH3)2Cl-CH(CH3)2+NaOH$→_{△}^{乙醇}$C(CH3)2=C(CH3)2+NaCl+H2O;
(2)D为 ,D发生取代反应生成E,反应方程式为
,D发生取代反应生成E,反应方程式为 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)G的结构简式为 ,故答案为:
,故答案为: ;
;
(4)F为 ,含有苯环同分异构体中,其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是
,含有苯环同分异构体中,其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是 ,
,
故答案为: ;
;
(5)由苯与浓硝酸、浓硫酸在加热条件下得到H为硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为 ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到 ,最后加成反应还原得到
,最后加成反应还原得到 ,
,
故反应条件1所选用的试剂为:浓硝酸、浓硫酸,反应条件2所选用的试剂为:Fe粉/稀盐酸,I的结构简式为  ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生获取信息并灵活运用信息解答问题能力,根据题给信息、反应条件、分子式进行推断,正确推断A、D结构简式是解本题关键,难点是(4)题同分异构体种类判断,题目难点中等.


科目:高中化学 来源: 题型:解答题
 .
.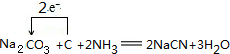 .
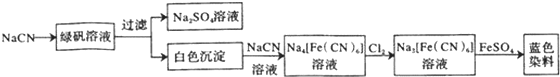
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能加入了H2 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| B. | 加热灼烧后的坩锅放置在实验桌上冷却至室温 | |
| C. | 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭 | |
| D. | 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
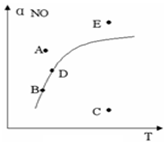 在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )| A. | A点反应未达到平衡状态,且反应正向移动 | |
| B. | C点NO转化率最低,且化学反应速率最小 | |
| C. | B、D两点均处于相应温度下的化学平衡状态,且αB(NO)<αD(NO) | |
| D. | E点反应未达平衡,反应正向移动,容器类压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应是炼铁最常用的方法 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 | |
| D. | 袋装食品常用生石灰包作为食品的抗氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com