
 碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
分析 (1)0~1min内参加反应的氢气为8mol-5mol=3mol,再根据v=$\frac{△c}{△t}$计算v(H2);
(2)正反应为气体物质的量减小的反应,增大压强平衡正向移动,CO的转化率增大;
p2、195℃时,A点处于平衡状态,CO的转化率为0.5,B点CO的转化率为0.6,大于平衡时转化率,故B点反应向逆反应进行;
(3)CO和H2起始物质的量之比为1:2,开始氢气为8mol,则CO起始量为4mol,p2、195℃时,A点处于平衡状态,CO的转化率为0.5,转化的CO为4mol×0.5=2mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):4 8 0
变化量(mol):2 4 2
平衡量(mol):2 4 2
再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数.
解答 解:(1)0~1min内参加反应的氢气为8mol-5mol=3mol,则v(H2)=$\frac{\frac{3mol}{20L}}{1min}$=0.15mol/(L.min),
故答案为:0.15;
(2)正反应为气体物质的量减小的反应,增大压强平衡正向移动,CO的转化率增大,故压强p1<p2;
p2、195℃时,A点处于平衡状态,CO的转化率为0.5,B点CO的转化率为0.6,大于平衡时转化率,故B点反应向逆反应进行,则υ正<υ逆,
故答案为:<;<;
(3)CO和H2起始物质的量之比为1:2,开始氢气为8mol,则CO起始量为4mol,p2、195℃时,A点处于平衡状态,CO的转化率为0.5,转化的CO为4mol×0.5=2mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):4 8 0
变化量(mol):2 4 2
平衡量(mol):2 4 2
容器容积为20mL,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{2}{20}}{\frac{2}{20}×(\frac{4}{20})^{2}}$=25,
故答案为:25.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数、化学平衡图象等,难度中等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通过Na2O2粉末 | B. | 铝与Fe2O3发生铝热反应 | ||
| C. | 碳与SiO2电炉中抽取粗硅 | D. | 将锌片投入CuSO4溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.2mol | C. | 0.225mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
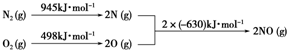
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.
已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com