
X、Y、Z为三种单质,已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此推断下列说法中可能正确的是
①单质的氧化性:Y>Z>X
②单质的还原性:Y>Z>X
③对应离子的氧化性:X>Z>Y
④对应离子的还原性:X>Z>Y
A.只有① B.只有②③
C.只有①④ D.①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
科学家最近在-100 ℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型。下列说法中错误的是( )

A.烃X的分子式为C5H4
B.分子中碳原子的化学环境有2种
C.具有2个三元环的X的同分异构体的种类共2种(含本身)
D.X分子中只有C—C单键,没有C===C双键
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________(保留小数点后四位)。
[实验二] 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋 酸的pH,结果如下:
酸的pH,结果如下:
| 醋酸浓度(mol/L) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:________________________________________________________________________
________________________________________________________________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________(填“增大”、“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 _________ ;它含有的化学键类型有 _________
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化 还原反应中,1 mol H2O得到1 mol电子的是
还原反应中,1 mol H2O得到1 mol电子的是
A.Cl2+H2O===HCl+HClO
B.2Na2O2+2H2O===4NaOH+O2↑
C.2Na+2H2O===2NaOH+H2↑
D.3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河水进行消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-转移
D.Na2FeO4能杀菌消毒是因为其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是验证氯酸钾和浓盐酸反应的装置,乙、丙是师生对实验改进后的装置[已知:KClO3+6HCl(浓) 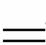 KCl+3Cl2↑+3H2O]:
KCl+3Cl2↑+3H2O]:

(1)和装置甲相比,装置乙的优点是__________________________________________。
(2)和装置B相比,装置D制备氯气的优点是_____________________________________________。
(3)为了进一步验证氯气和水的反应,某学生设计了装置丙。如何控制弹簧夹才能使氯气充满集气瓶F?
__________________________________________。
(4)当气体充满集气瓶F后,欲使装置E中的水进入集气瓶F应如何操作?
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容中发生下列反应aA(g)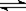 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是 ( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com