
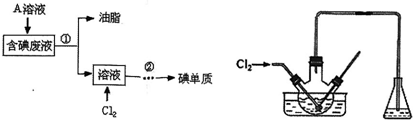
分析 往含碘废液中加入还原性的物质,将废液中的I2还原为I-,油脂不溶于水,用分液的方法分离得到油脂和溶液,然后在溶液中加强氧化剂氯气氧化碘离子,萃取分液蒸馏得到碘单质,达到分离提纯的目的,
(1)A溶液是某还原剂,加入目的是还原废液中的碘单质为碘离子;
(2)操作①是分液分离,依据分液操作选择仪器;
(3)操作②是水溶液中得到碘单质的提取方法是萃取分液蒸馏分离得到碘单质;
(4)碘易升华,且氯气的溶解度随着温度的升高而减小;过量的氯气会将碘单质氧化为碘酸盐,氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
解答 解:往含碘废液中加入还原性的物质,将废液中的I2还原为I-,油脂不溶于水,用分液的方法分离得到油脂和溶液,然后在溶液中加强氧化剂氯气氧化碘离子,萃取分液蒸馏得到碘单质,达到分离提纯的目的,
(1)A溶液是某还原剂,加入目的是还原废液中的碘单质为碘离子,向含碘废液中加入稍过量A溶液的目的是:将废液中的碘单质还原为碘离子进入水层,
故答案为:将废液中的碘单质还原为碘离子进入水层;
(2)操作①是分液分离,依据分液操作选择仪器为分液漏斗、烧杯,
故答案为:分液漏斗、烧杯;
(3)操作②是水溶液中得到碘单质的提取方法是萃取分液蒸馏分离得到碘单质,溶液中加入萃取剂,萃取碘单质,通过分液漏斗分液得到有机萃取层,通过蒸馏得到碘单质,
故答案为:操作②是萃取、分液、蒸馏;
(4)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在30~40℃温度条件下进行反应,过量的氯气会将碘单质氧化为IO3-,5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气,
故答案为:温度太低反应太慢,温度过高氯气溶解度会变小,过量的氯气会将碘单质氧化为IO3-,5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;NaOH;
点评 本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 现象或事实 | 解释 |
| A | 可用铁制容器储存、运输浓硫酸 | 常温下铁与浓硫酸不反应 |
| B | 可用二氧化硫漂白纸浆、草帽等 | 二氧化硫具有氧化性 |
| C | 可用碳酸钠溶液将水垢中的硫酸钙转化为碳酸钙 | Ksp(CaSO4)>Ksp(CaCO3) |
| D | 福尔马林常用来保存新鲜食品 | 福尔马林具有杀菌防腐性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
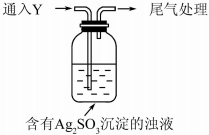 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D是非金属性最强的元素 | |
| B. | B的单质有多种同分异构体,其中一种是自然界中最坚硬的物质 | |
| C. | B的氢化物的稳定性大于D的氢化物 | |
| D. | A与C只能够形成两种化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com