
����Ŀ�������������ʹ�õĽ���֮һ�������仯�������ִ��������������й㷺��Ӧ�ã�
I�������敏Fe2O3���ù�ҵFeCl3��Ʒ����Ca��Mn��Cu���������ӣ���ȡ�ߴ����죬ʵ���ҳ�����ȡ��X�����춡����ͪ����ȡ����ȡ�ߴ��������Ҫʵ�鲽�����£�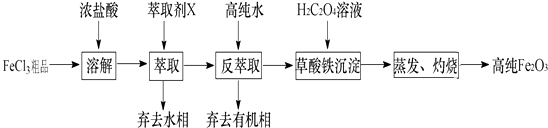
��֪��HCl��Ũ��+FeCl3HFeCl4 �� �Իش��������⣺
��1������ȡ��X��ȡ���ò����У�
��Ca2+��Mn2+��Cu2+������������Ҫ�����ˮ�����л������࣮
����ʵ��ʱ������ȡ��X 150mL����ȡ����ߵķ�����������ĸ����
a��һ������ȡ��150mL b����2����ȡ��ÿ��75mL c����3����ȡ��ÿ��50mL
��2���øߴ�ˮ����ȡ����ȡ��ˮ�������Ĵ�����ʽ����д��ѧʽ��������ȡ�ܷ�����ԭ���� ��
��3�����ò������������ñ�ˮϴ�ӣ���Ŀ��һ��ϴȥ���������������������ӣ����� ��
��4���ⶨ��Ʒ�����ĺ����辭���ܡ���ԭΪFe2+ �� Ȼ���������������ñ�K2Cr2O7��Һ�ζ�����֪���Ļ�ԭ����ΪCr3+ �� д���õζ���Ӧ�����ӷ���ʽ ��
��5��II���������Ω�����ͭ��CuFe2O4���Ǻ���ǰ�����Ȼ�ѧ�ֽ�ˮ����IJ��ϣ�CuFe2O4����������п���ѭ��ʹ�ã����Ȼ�ѧѭ���ֽ�ˮ����Ĺ����У�����ͭ��CuFe2O4����Ҫ���ճ���ȱλ�壨CuFe2O4��a������ȱλֵ��a��Խ����Խ�ߣ�����Խ���ף�
����������ʾ��д����ȱλ����ˮ�����·�Ӧ����Ļ�ѧ����ʽ ��
��6������С�齫����ͭ��Ʒ��N2�������г�����գ�����ȱλ�������Ϊԭ������96.6%������ȱλֵ��a��=���������С�����2λ��
���𰸡�
��1��ˮ��c
��2��FeCl3���Ӹߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3?HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ�
��3�����ٲ�����������ܽ����
��4��6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O
��5��CuFe2O4��a+aH2O=CuFe2O4+aH2��
��6��0.51
���������⣺��1����������ͼ��֪��FeCl3��Ʒ�������ᣬ�õ�����Fe3+��Ca2+��Mn2+��Cu2+�����ӵ���Һ����X��ȡ���ٷ���ȡȥ���л��༴�ɵõ��ϴ��ĺ�Fe3+����Һ����������ȡʱCa2+��Mn2+��Cu2+Ӧ��ˮ���У���ȡ��X����һ��ʱ����ȡ�Ĵ���Խ�࣬Ч��Խ�ã���ѡc��
���Դ��ǣ�ˮ��c��
��2.������Ԫ���غ��֪����ȡ��ˮ�������Ĵ�����ʽ��FeCl3 �� �ü��춡����ͪ��ȡʱ�����л�������Ԫ������ʽ����HFeCl4 �� ���ڼӸߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ��������øߴ�ˮ���Խ��з���ȡ��
���Դ��ǣ�FeCl3���Ӹߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ���
��3.���ñ�ˮϴ�ӿ��Լ��ٲ�����������ܽ���ģ�
���Դ��ǣ����ٲ�����������ܽ���ģ�
��4.��������������Fe2+��K2Cr2O7��Һ��Ӧ����Cr3+�������ӣ���Ӧ�����ӷ���ʽΪ6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O��
���Դ��ǣ�6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O��
��5.����ȱλ�壨CuFe2O4��a�����Զ�ȡˮ�������е���ԭ�ӣ��Ӷ�������������Ӧ�Ļ�ѧ����ʽΪCuFe2O4��a+aH2O=CuFe2O4+aH2����
���Դ��ǣ�CuFe2O4��a+aH2O=CuFe2O4+aH2����
��6.��������ͭ��Ʒ��N2�������г�����գ����ٵ�������Ϊʧȥ����Ԫ�ص�����������CuFe2O4=CuFe2O4��a+ ![]() aO2��֪
aO2��֪ ![]() ��100%=1��96.6%������a=0.51��
��100%=1��96.6%������a=0.51��
���Դ��ǣ�0.51��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.95�洿ˮ��pH��7��˵�����ȿɵ���ˮ������
B.��ˮ�м�������ϡ���ᣬc��H+������KW����
C.��ˮ�м��백ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ���c��OH��������
D.pH=3�Ĵ�����Һ��ϡ����10����pH=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO2��Һ�ڲ�ͬ�¶��¾��ɱ�����KlO3��������NaHSO3��ȫ���ļ���I2����������I2��������ʱ��������NaHSO3�ķ�Ӧ���ʣ���Ũ�Ⱦ�Ϊ0.020 molL��1��NaHSO3��Һ�����������ۣ�10.0 mL��KIO3��������������Һ40.0 mL��ϣ���¼10��55�����Һ����ʱ�䣬55��ʱδ�۲쵽��Һ������ʵ������ͼ����ͼ�����������жϲ���ȷ���ǣ� �� 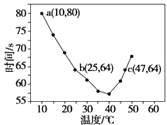
A.40��֮ǰ��40��֮����Һ������ʱ�����¶ȵı仯�����෴
B.ͼ��a���Ӧ��NaHSO3��Ӧ����Ϊ5.0��10��5 molL��1s��1
C.ͼ��b��c�����Ӧ��NaHSO3��Ӧ�������
D.40��֮���۲���������ʵ���ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�������0.1mol/L�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ���ǣ� ��
A.��Һ�е������ӵ���Ŀ����
B.����ĵ���̶�����c��H+��������
C.��Һ�� ![]() ����
����
D.��Һ�� ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ輰�仯����������У�����ȷ����
A.ˮ��������ճ�ϼ����ͻ����B.������뵼�����
C.���������ǹ��ά��ԭ��D.�������մ���������Ԫ���IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ���ǣ�������
A.����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B.���³�ѹ�£�44g CO2���е�ԭ����Ϊ3NA
C.���³�ѹ�£�11.2L����������ԭ����ΪNA
D.��״���£�11.2L H2O ���еķ�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO��g��+2H2��g��CH3OH��g��
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ�� ��
A.����CH3OH������������CO���������
B.���������ܶȲ���
C.�����������ƽ��������������
D.CH3OH,CO,H2��Ũ�ȶ����ٷ����仯
E.�����ѹǿ���ٸı�
��2�������������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ �� ��ʱ���¶�Ϊ ��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
a������ b��������� c������CO��Ũ�� d�������¼���H2ʹѹǿ���
e�������¼����������ʹѹǿ��� f��������״�
��4����250��ʱ�����ij�ܱ������и����ʵ����ʵ���Ũ�ȼ�����
CO | H2 | CH3OH |
0.5molL��1 | 2molL��1 | 6molL��1 |
��ʱ��Ӧ�������淴Ӧ���ʵĹ�ϵ�ǣ�v������v���棩��������������T������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϳ�����õ�˵��������� �� ��
A. ����Ҫ������� B. ����Ŀ�������ָ��������Խ��Խ��
C. ����ȼ��ȼ��ǰҪ���� D. Һ��ȼ��ȼ��ʱ������״���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ã�����ͨ������X���ɿ���a���к�ɫ�������ɣ�b��������c���õ�Һ�壬������X������(����)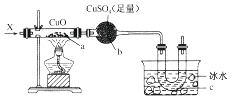
A.H2
B.CO��H2
C.NH3
D.CH3CH2OH(����)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com