
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
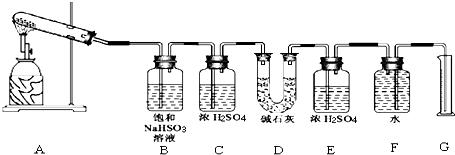
分析 [提出猜想]根据硫酸钙分解可能发生两种情况2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑或 CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$CaO+SO3↑,或者两个反应同时发生来判断;
[实验过程]
(1)若实验结束时装置G中量筒没有收集到水,说明生成的气体完全被吸收;
(2)若实验结束,经测定装置D的总质量增加了,碱石灰可以吸收二氧化硫、三氧化硫,不能肯定气体产物中含有SO2而不含SO3;SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2;
(3)装置G、F液面差不同读数引起误差;
(4)测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CaSO4分解的化学方程式;测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CaSO4分解的化学方程式;
解答 解:[提出猜想]Ⅱ.根据硫酸钙分解可能发生两种情况2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑或 CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$CaO+SO3↑,或者两个反应同时发生来判断,所得气体的成分可能只含 SO3一种,所得气体的成分可能含有SO2、O2,所得气体的成分可能含有 SO2、SO3、O2三种,
故答案为:SO2、O2;
[实验过程]
(1)若实验结束时装置G中量筒没有收集到水,说明生成的气体完全被吸收,因为生成二氧化硫时一定生成氧气,氧气不能被吸收,所以生成的气体只能是三氧化硫,所以I是正确的,故选I,
故答案为:Ⅰ;
(2)若实验结束,经测定装置D的总质量增加了,二氧化硫和三氧化硫都是酸性氧化物,碱石灰可以吸收二氧化硫、三氧化硫,SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2;
故答案为:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2;
(3)该实验设计中,容易给测定带来较大误差的因素有,排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差最大,
故答案为:排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差;
(4)二组、设5.44g硫酸钙分解生成xmolSO3,ymolSO2,则有
80x+64y=2.56
x+y=$\frac{5.44g}{136g/mol}$=0.04
解之得:x=0,y=0.04mol,
又n(O2)=$\frac{448×1{0}^{-3}}{22.4}$=0.02mol,所以二者的物质的量之比为2:1,方程式:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑;
故答案为:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
点评 本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com