
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| C. | 在常温常压下,1摩尔气体含有的原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO、Fe2O3、Na2O2均为碱性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 盐酸、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
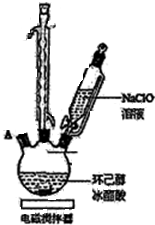 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |
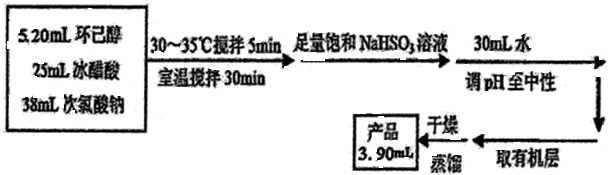
 .
. ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
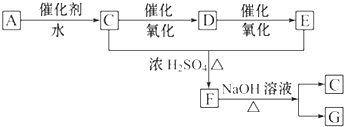
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

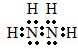
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com