
下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol·L-1NH4Cl与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:
c(Na+)=C(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是
A. K+、MnO4-、Cl–、SO42- B. Na+、AlO2-、NO3-、CO32-
C. Na+、、H+、NO3-、SO42- D. Na+、SO32-、S2-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,阴离子浓度最大的是
A. 0.5mol/L H2SO4溶液50mL B. 0.6mol/L Al2(SO4)3溶液35mL
C. 0.8mol/L NaCl溶液70mL D. 0.7mol/L Na2CO3溶液60mL
查看答案和解析>>
科目:高中化学 来源: 题型:
将7.8g铁粉加入200mL2mol/L的HNO3溶液中,使之充分反应放出NO气体,所得溶液中主要离子浓度的大小关系是
A.c(NO3-)>c(Fe2+)>c(Fe3+)>c(H+) B.c(NO3-)>c(Fe3+)>c(Fe2+)>c(H+)
—4—
C.c(Fe2+)>c(Fe3+)>c(NO3-)>c(H+) D.c(Fe2+)>c(NO3-)>c(Fe3+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO32-)之比为2:1
C.0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子的溶液中,加入FeBr2晶体时,有两种离的浓度明显减小的是
A. K+、OH-、CO32- B. Na+、Ag+、NO3- C. K+、SO42-、S2- D. H+、Cu2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是
—7—
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、ClO-
C. H+、Mg2+、SO42-、NO3- D. Ag+、K+、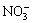 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1) 联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子
联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子 式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮做氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,则推进剂中联氨的质量________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3===5N2+6H2O 6NO2+ 8NH3===7N2+12H2O。NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。则①该混合气体中NO与NO2的体积比为________,②吸收后氨水的物质的量浓度________(答案保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com