
| A. | c (HCN)<c (CN-) | B. | c (Na+)=c (CN-) | ||
| C. | c (HCN)-c (CN-)=c (OH-) | D. | c (HCN)+c (CN-)=0.1mol•L-1 |
分析 将0.2 mol•L-1 HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合后,所得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,由于混合后溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,结合电荷守恒和物料守恒解答该题.
解答 解:A.混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,则:c(HCN)>c(CN-),故A错误;
B.据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),溶液显碱性,则:c(OH-)>c(H+),则c (Na+)>c (CN-),故B错误;
C.由物料守恒可知c(HCN)+c(CN-)=2c(Na+),又据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),二者联立整理可得:2c(H+)+c(HCN)+c(CN-)=2c(CN-)+2c(OH-),则2c(H+)+c(HCN)=c(CN-)+2c(OH-),c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.由物料守恒可得:c(HCN)+c(CN-)=0.1mol•L-1,故D正确;
故选D.
点评 本题考查了混合溶液中离子浓度大小比较,为高考常见题型,侧重于学生的分析能力的考查,难度较大,注意电荷守恒和物料守恒的运用,把握盐类水解的特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分离汽油和煤油 | B. | 将重油分离为润滑油等 | ||
| C. | 将直链烃变为芳香烃 | D. | 十六烷变为辛烷和辛烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
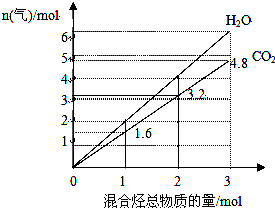 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有丙烷 | D. | 一定没有丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加水稀释2倍后,两溶液的pH均减小 | |
| D. | 加足量的锌充分反应后,盐酸中产生的氢气速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 基态原子电子排布式为[Ne]3s23p1的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃,20mL、3mol/L的Na2S2O3溶液 | B. | 20℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 20℃,30mL、2mol/L的Na2S2O3溶液 | D. | 10℃,10mL、2mol/L的Na2S2O3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL | B. | 5mL | C. | 大于10mL | D. | 小于5mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com