
为了研究浓度、温度对化学反应速率的影响,利用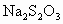 ,(3%)在酸性条件下产生不溶于水的S,形成乳白色浑浊的反应,测量所需时间来证明不同浓度或不同温度下化学反应速率的不同.
,(3%)在酸性条件下产生不溶于水的S,形成乳白色浑浊的反应,测量所需时间来证明不同浓度或不同温度下化学反应速率的不同.
(1)写出该反应的离子方程式______________________.
(2)取3个小烧杯,编号为1、2、3,在烧杯底部中央画上粗细相伺的“+”号,按下表分别进行处理,记下从澄清到看不到“+”号所需的时间.
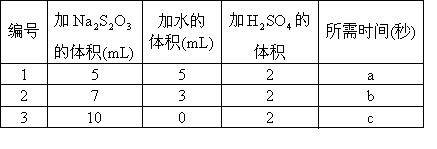
加水的作用是_________________________.
a、b、d三者的关系为_________________________.
(3)要研究温度对化学平衡的影响,应进行的操作是_________________.
科目:高中化学 来源: 题型:阅读理解
 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
| ||
| ||
| 实验编号 | T/℃ | H2O2初始浓度/ mol?L-1 |
FeCl3初始浓度/ mol?L-1 |
| Ⅰ | 20 | 1.0 | 0 0 |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | 1.0 1.0 |
0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
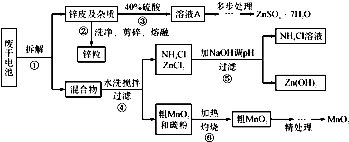
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实 验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
| 组别 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com