
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。
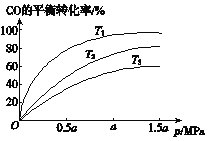
②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
【答案】2ΔH1+ΔH2/3+2ΔH3/3 FeO、Fe 60% 无法确定 75%或0.75 T1<T2<T3 右
【解析】
(1)根据盖斯定律,将所给的反应①×2+②/3+③×2/3可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);
(2)由表给数据可知1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物,依据铁、氧质量比计算物质的量比,依据物质的量比计算FeO被CO还原为Fe的百分率;
(3)①由图可知40min时反应达到平衡,平衡时CO的体积分数为0.1,依据三段式可计算平衡时CO的转化率,但容器体积无法确定,不能计算此反应的平衡常数K;
②该反应为气体物质的量减少的放热反应,升高温度,平衡左移,增大压强,平衡右移。
(1)根据盖斯定律,将所给的反应①×2+②/3+③×2/3可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故ΔH=2ΔH1+ΔH2/3+2ΔH3/3,故答案为:2ΔH1+ΔH2/3+2ΔH3/3;
(2)根据在1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:(x+y)/x=(35/56)/(4/16),得x:y=3:2,故剩余的FeO和被还原为铁的FeO的物质的量之比为3:2,则可知被还原的FeO的百分比为3/(3+2)×100%=60%,故答案为:FeO和Fe;60%;
(3) ①设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
初始(n):2mol 6mol 0 0
△n: xmol 3xmol xmol xmol
平衡(n):(2-x)mol(6-3x)mol xmol xmol
由题给数据可知40min时反应达到平衡,平衡时CO的体积分数为0.1,则有(2-x)/(8-2x)=0.1,解得x=1.5 mol,因无法确定平衡时容器体积,无法计算平衡时浓度,故无法计算反应的平衡常数K;达到平衡时CO的转化率为=1.5mol/2mol×100%=75%,故答案为:无法确定;75%;
②反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H<0,升高温度,平衡左移,CO的平衡转化率越低,根据图象可知,温度T1<T2<T3;其它条件固定时,增加压强会导致平衡向化学计量数减小的正反应方向移动,故答案为:T1<T2<T3;右。
CH4(g)+H2O(g)△H<0,升高温度,平衡左移,CO的平衡转化率越低,根据图象可知,温度T1<T2<T3;其它条件固定时,增加压强会导致平衡向化学计量数减小的正反应方向移动,故答案为:T1<T2<T3;右。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:
(1)若要比较镁、铝的金属性强弱,下列方案可行的是:____________(填序号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将等量的这两种元素的单质粉末分别与同浓度的盐酸反应
c.将这两种元素的单质粉末分别与热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:______________________________________________。
(3)利用如图装置(夹持装置省略)可以验证部分元素的非金属性强弱。
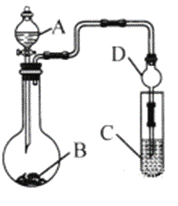
①实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的化学方程式为:_____________________________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为:_____________________________。
②若要自选药品证明非金属性:C>Si,则A中加__________、B中加Na2CO3粉末、C中加_____________,观察到C中溶液的现象为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O![]() CH3COO+2H++2Ag↓+3NH3↑+
CH3COO+2H++2Ag↓+3NH3↑+![]()
B. 苯酚钠溶液中通入少量CO2:![]() +H2O+CO2
+H2O+CO2![]()
![]() +
+![]()
C. 硫酸氢铵溶液中滴加少量NaOH溶液:H++![]() +2OH
+2OH![]() NH3·H2O+H2O
NH3·H2O+H2O
D. 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH![]() CH2ClCOO+H2O
CH2ClCOO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表回答下列问题:
(1)写出元素Cu的基态原子的电子排布式:____________________。
(2)某元素A的核外价电子排布式为nsnnpn+1,该元素A原子核外最外层电子中成对电子共有________对。此元素A原子与O的第一电离能的相对大小为:A________ O(填“<”“>”或“=”)。
(3)元素C形成的最高价氧化物中含有________个π键。C和Cl形成化合物的电子式为_____________,此化合物中C的杂化方式为________。
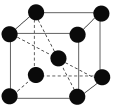
(4)已知元素钒形成单质的晶胞如下图所示,则其原子的配位数是________,假设晶胞的边长为d cm、密度为ρ g·cm-3,则元素钒的相对原子质量为_____________ (NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____ mol/(L·s)。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A.压强不再变化 B.v(A)正=2v(B)逆
C 气体密度不再变化 D.A的百分含量保持不变
E.A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”),负极反应式为______。
(2)当有 1mol电子流经外电路时,负极质量减少______g。
(3)溶液中的 OH-向________极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验,标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1).该烃的摩尔质量为________。
(2).该烃的分子式为________。
(3).该烃有一种可能的结构为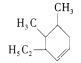 ,其名称为________。
,其名称为________。
(4).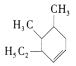 属于________(选填序号)。
属于________(选填序号)。
a.环烃 b.烷烃 c.芳香烃 d.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
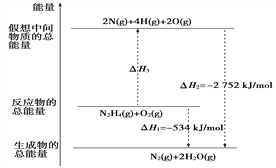
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com