
阿伏加德罗常数的值为6.02×1023mol-1,下列叙述中错误的是:
①12.4g 白磷晶体中含有的P-P键数是0.6×6.02×1023
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0. 1×6.02×1023
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1mol O2在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数等于2×6.02×1023
⑤2.9g 2CaSO4•H2O含有的结晶水分子数为0.02×6.02×1023
A.①②③④⑤ B. ①③④⑤ C. ②③④⑤ D. ③④⑤
科目:高中化学 来源: 题型:
SiCl4的分子结构与CCl4类似,对其作出如下推断,其中正确的是( )
①SiCl4晶体是分子晶体 ②常温、常压下SiCl4是液体
③SiCl4的分子是由极性键形成的 ④SiCl4熔点高于CCl4
A.全部 B.只有①② C.只有②③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮(C3H6O)通常是无色液体,与水混溶,密度小于1g·mL-1,沸点约为56℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是 ( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
用18 mol·L-1 浓硫酸配制100 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的操作是
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型镁铝合金的化学式为Mg17Al12,它具有储氢性能,该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。下列说法正确的是
A.该合金的熔点介于金属镁和金属铝熔点之间
B.该合金中镁元素呈负价,铝元素呈正价
C.1mol Mg17Al12完全吸氢后得到的混合物Y与盐酸完全反应释放出H2,若消耗盐酸的体积为14L,则该盐酸的物质的量浓度为5mol.L-1
D.制备该合金应在氩气保护下,将一定比例的Mg、Al单质在一定温度下熔炼而获得
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。则下列选项正确的是
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
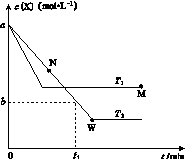
查看答案和解析>>
科目:高中化学 来源: 题型:
素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com