
| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 5:1 |
分析 反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O,反应中Cl2自身发生氧化还原反应,生成KCl的反应为被还原的过程,Cl2为氧化剂,生成KClO3的为被还原的过程,Cl2为还原剂,以此解答该题.
解答 解:反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O,Cl2自身发生氧化还原反应,生成KCl的反应为被还原的过程,Cl2为氧化剂,生成KClO3的为被还原的过程,Cl2为还原剂,
则如有3molCl2参加反应,氧化剂为2.5mol,还原剂为0.5mol,则氧化剂与还原剂的质量之比是2.5:0.5=5:1,
故选D.
点评 本题考查氧化还原反应的计算,题目难度不大,注意根据反应中元素化合价的变化判断氧化剂和还原剂等相关概念,结合反应的方程式进行计算.


科目:高中化学 来源: 题型:解答题
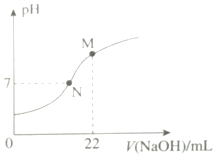 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( ) | 恒容容器甲 | 恒压容器乙 | |
| X的物质的量(mol) | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前小 | |
| B. | 平衡时容器甲的压强一定比反应前小 | |
| C. | n2>n1 | |
| D. | φ2<φ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F的原子结构示意图: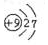 | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: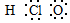 | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com