
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究。
【提出问题】①氧化铜是否也能做氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
【查阅资料】研究表明,许多金属氧化物对氯酸钾的分解有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如下表所示:
催化剂 温度 反应程度 | 氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 |
开始反应 | 420℃ | 515℃ | 305℃ | 490℃ |
剧烈反应 | 490℃ | 540℃ | 350℃ | 545℃ |
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是___________。
【设计并完成实验】
Ⅰ. 将3.0g氯酸钾放在试管中加热
Ⅱ. 将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ. 将3.0g氯酸钾与Xg氧化铜均匀混合加热
【实验现象分析】
Ⅲ中X的值应为_____________,实验Ⅰ和Ⅲ比较可证明______________________。 现象与实验Ⅲ相同.实验Ⅱ和Ⅲ对比的目的是______________________。将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,然后进行称量的目的是_____________________________,最后还要再将黑色粉末和_______________混合加热进行实验。
【结论】氧化铜也能作氯酸钾分解的催化剂,实验Ⅲ中的化学反应的化学方程式为_____________________________________________________。
【实验反思】MnO2的用量对 H2O2分解反应有何影响?
【设计并完成实验】利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中为3% H2O2溶液,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计。)
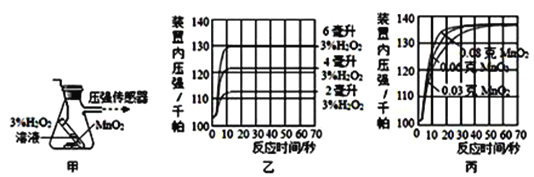
【讨论交流】(1)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出________________________________。图丙是“不同质量的MnO2与相同体积的3%H2O2溶液混合”的实验结果,从图中可以看出____________________________________。
【答案】 氧化铜 1.0 氧化铜能加快氯酸钾分解的速度;比较二氧化锰与氧化铜的催化效果 过滤 验证氧化铜的质量在化学反应前后是否改变 氯酸钾 ![]() 0.1克MnO2与不同体积的3%H2O2溶液混合,过氧化氢的用量越多,速度差不多,但产生的氧气越多 不同质量的MnO2与相同体积的3%H2O2溶液混合,二氧化锰越多,产生的氧气一样多,但速度会加快。
0.1克MnO2与不同体积的3%H2O2溶液混合,过氧化氢的用量越多,速度差不多,但产生的氧气越多 不同质量的MnO2与相同体积的3%H2O2溶液混合,二氧化锰越多,产生的氧气一样多,但速度会加快。
【解析】【查阅资料】由表中的数据可知,不用二氧化锰时选择氧化铜作催化剂时,开始的温度与剧烈反应时的温度是四种物质中最低的,是条件最容易达到的;
【实验现象分析】(1)控制氯酸钾的质量、二氧化锰和氧化铜的质量,才能比较出二氧化锰和氧化铜的催化效果,Ⅲ中X的值应为1g;实验Ⅰ和Ⅲ对比的目的是探究氧化铜是否能加快氯酸钾分解;实验Ⅱ和Ⅲ对比的目的是探究二氧化锰和氧化铜哪个对氯酸钾催化效果更好;催化剂在化学反应前后质量和化学性质不变;将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,然后进行称量,目的是探究氧化铜在反应后的质量是否不变;最后还要再将黑色粉末和氯酸钾混合加热,发现实验现象依然与之前现象相同;
【结论】氯酸钾在二氧化锰做催化剂的条件下分解成氯化钾和氧气,实验Ⅲ中的化学反应的化学方程式为:![]() :
:
【讨论交流】图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出0.1克MnO2与不同体积的3%H2O2溶液混合,过氧化氢的用量越多,产生的氧气越多,反应速率差不多;图丙是“不同质量的MnO2与相同体积的3%H2O2溶液混合”的实验结果,从图中可以看出不同质量的MnO2与相同体积的3%H2O2溶液混合,二氧化锰越多,反应速度越快,产生的氧气一样多。


科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。
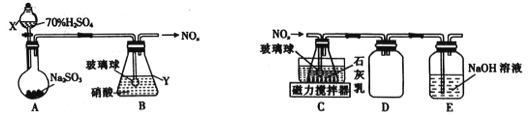
①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可获成功的是( )
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯
C. 将电石和饱和食盐水置于启普发生器中制取乙炔
D. 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,下列有关doggycene的说法正确的是( )
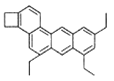
A. “doggycene”中所有碳原子不可能处于同一平面上
B. 该物质的分子式为C26H30
C. 常温下该有机物为气态
D. 1mol该物质在氧气中完全燃烧生成CO2和H2O的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲是ⅥA族元素,其单质和化合物在化工生产等方面具有广泛应用。
(1)TeO2是两性氧化物,微溶于水,可溶于强酸、或强碱。TeO2和NaOH溶液发生反应的化学方程式为______________。
(2)碲酸(H6TeO6)是一种很弱的酸,Ka1=1×10-7,该温度下0.1mol/L H6TeO6的电离度α为_____(结果保留一位有效数字)。在酸性介质中,碲酸可将HI氧化成I2,若反应生成的TeO2与Te的物质的量之比为1:1,试配平该化学方程式。_________
______HI+_____ H6TeO6=_____TeO2+_____Te+_____I2+_____H2O
(3)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如下:

① 已知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是______________。
② 防止局部酸度过大的操作方法是_____________。
③ 对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是______________。
④ “还原”得到固态碲后分离出粗碲的方法_________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用系统命名法给下列有机物命名。
①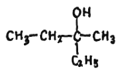 :_____________。
:_____________。
②CH2=C(CH3)CH=CH2:_____________。
(2)用S-诱抗素制剂,可以保证鲜花盛开。S-诱抗素的结构如图,回答下列问题:
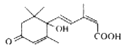
①其分子中含有_____个手性碳原子,请在图中用![]() 标出。
标出。
②1mol该有机物最多能与_______molH2发生加成反应。
(3)下列对抗结肠炎药物有效成分(![]() )可能具有的性质推测正确的是______。
)可能具有的性质推测正确的是______。
A.水溶性比苯酚好 B.能发生消去反应
C.能发生聚合反应 D.既有酸性又有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和H2合成甲醇,而CO和H2来源于煤的气化。回答下列问题。
(I).(1)己知:①H2(g)+1/2O2(g)=H2O(g) △H1=-241.8kJ/mol
②C(s)+ ![]() O2(g)=CO(g) △H2=-110.5kJ/mol
O2(g)=CO(g) △H2=-110.5kJ/mol
则焦炭与水蒸气反应的热化学方程式为_____________。
(2)已知反应CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ/mol中的相关化学键键能如下:
CH3OH(g) △H=-99kJ/mol中的相关化学键键能如下:
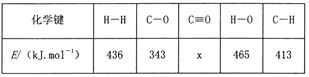
则x=________
(II)(3)在一容积可变的密闭容器中,lmolCO与2molH2发生反应:CO(g)+2H2(g) ![]() CH3OH(g), CO在不同温度下的平衡转化率(a)与总压强的关系如下图所示。
CH3OH(g), CO在不同温度下的平衡转化率(a)与总压强的关系如下图所示。
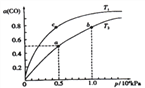
①该反应的△S_____0,图中的Tl____T2(填“>”、“<”或“=”)。
②该合成反应的温度一般控制在240~270℃,选择此温度范围的原因有:________。
③图中a点时以CH3OH的物质的量分数为_______,该反应的压强平衡常数为Kp=______(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I: CO(g)+2H2(g) ![]() CH3OH(g) △H1
CH3OH(g) △H1
II:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
III:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) △H31
CH3OH(g) +H2O(g) △H31
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。

则△H1______△H3(填“>”、“<”或“=”)。理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某种盐后铜粉逐渐溶解,这种盐是( )
A.NaCl B.KNO3 C.K2SO4 D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com