
| A. | 减少少量W,逆反应速率减小 | |
| B. | 当容器中气体的平均相对分子质量不变时,反应达到平衡 | |
| C. | 降低温度,平衡正向移动 | |
| D. | 平衡后加入Z,上述反应的△H减小 |
分析 A、固体量的增减不会影响反应速率,不会引起化学平衡的移动;
C、降低温度,平衡向放热方向移动;
B、容器中气体的平均相对分子质量等于质量和物质的量的比值,反应前后气体的物质的量不变,质量变化,据此判断;
D、反应热△H与物质的化学计量数有关,与参加反应的物质的物质的量无关.
解答 解:A、W在反应中是固体,固体量的增减不会引起化学反应速率的改变和化学平衡的移动,故A错误;
B、容器中气体的平均相对分子质量等于气体质量和气体物质的量的比值,反应前后气体的物质的量不变,质量变化,混合气体的平均相对分子质量不变化时,说明可逆反应到达平衡状态,故B正确;
C、该反应正反应为吸热反应,升高温度平衡向吸热反应移动,即向正反应移动,降低温度,平衡逆向移动,故C错误;
D、反应热△H与物质的化学计量数有关,物质的化学计量数不变,热化学方程式中反应热不变,与参加反应的物质的物质的量无关,故D错误;
故选B.
点评 本题考查平衡移动、外界条件对平衡的影响、平衡状态判断等,难度不大,注意基础知识的掌握.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| 选项 | n(Cl2)/n(FeBr2) | 离子方程式 |
| A | 1:1 | 2Cl2+2Fe3++2Br-=2Fe3++Br2+4Cl- |
| B | 2:1 | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
| C | 1:2 | Cl2+2Br-=Br2+2Cl- |
| D | 2:3 | 4Cl2+62Fe2++2Br-=6Fe3++Br2+8Cl- |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
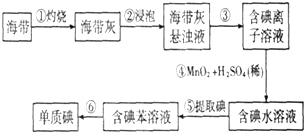
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 | |
| B. | H2O与H2S的空间结构一样是由共价键的饱和性决定的 | |
| C. | 并非所有的共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com