
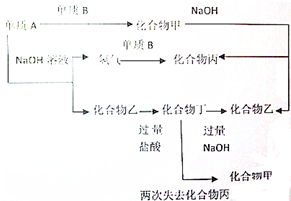
 下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断:
下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断:分析 各单质和化合物的组成元素的原子序数均小于18,A能和氢氧化钠溶液发生置换反应,产生氢气,则A铝或硅,
当A是铝时,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,乙是偏铝酸钠,铝和单质B反应生成甲,甲能和氢氧化钠溶液反应生成化合物乙,应为氧化铝能和氢氧化钠溶液反应,所以B是氧气,甲是氧化铝,则丙是水,偏铝酸钠和过量盐酸反应生成丁为氯化铝,而氯化铝不能两次失去水生成氧化铝,所以不符合转化关系;
当A是硅时,硅和氢氧化钠溶液反应生成硅酸钠和氢气,所以乙是硅酸钠,硅和B反应生成甲,甲能和氢氧化钠溶液反应,则甲是酸性氧化物,所以B是氧气,甲是二氧化硅,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,所以丙是水,硅酸钠和过量盐酸反应生成丁为原硅酸,原硅酸两次失去水分子生成二氧化硅,符合转化关系,据此答题.
解答 解:各单质和化合物的组成元素的原子序数均小于18,A能和氢氧化钠溶液发生置换反应,产生氢气,则A铝或硅,
当A是铝时,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,乙是偏铝酸钠,铝和单质B反应生成甲,甲能和氢氧化钠溶液反应生成化合物乙,应为氧化铝能和氢氧化钠溶液反应,所以B是氧气,甲是氧化铝,则丙是水,偏铝酸钠和过量盐酸反应生成丁为氯化铝,而氯化铝不能两次失去水生成氧化铝,所以不符合转化关系;
当A是硅时,硅和氢氧化钠溶液反应生成硅酸钠和氢气,所以乙是硅酸钠,硅和B反应生成甲,甲能和氢氧化钠溶液反应,则甲是酸性氧化物,所以B是氧气,甲是二氧化硅,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,所以丙是水,硅酸钠和过量盐酸反应生成丁为原硅酸,原硅酸两次失去水分子生成二氧化硅,符合转化关系,
(1)通过以上分析知,单质A是硅,故答案为:硅;
(2)单质B是氧气,故答案为:氧气;
(3)通过以上分析知,甲为SiO2,乙为Na2SiO3,丙为H2O,丁为H4SiO4,故答案为:SiO2;Na2SiO3;H2O;H4SiO4.
点评 本题考查了物质的推断,明确物质的性质及其转化关系是解本题关键,采用正逆相结合的方法进行推断,难度较大


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
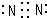 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X分子的空间构型为三角锥形.
,X分子的空间构型为三角锥形.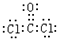 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
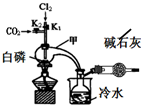 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液 | |
| C. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 | |
| D. | 苯(苯酚):加氢氧化钠溶液,充分振荡,分液,弃去下层液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com