
【题目】以炼锌烟尘(主要成分为 ZnO,含少量 CuO 和 FeO)为原料,制取氯化锌晶体(ZnCl2xH2O) 的工艺流程如下:
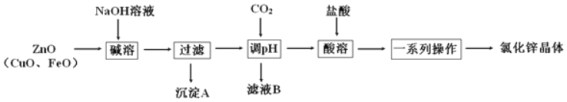 已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
(1)“调 pH”步骤中通入过量 CO2 时发生反应的离子方程式为_____。
(2)下列说法正确的是_____。
A.加入过量 NaOH 溶液的目的是提高锌元素的浸取率
B.沉淀 A 主要成分是 CuO、FeO
C.洗涤沉淀时,直接将洗涤液加入漏斗,并用玻璃棒轻轻搅拌
D.利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)氯化锌晶体(ZnCl2xH2O)是白色晶体,可含 1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是 SOCl2(SOCl2 熔点为﹣105℃、沸点 78.8℃、遇水剧烈水解生成两种酸性气体)。
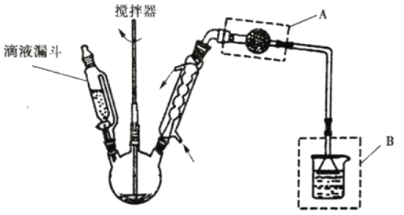
①下列物质中最适合洗涤氯化锌晶体的是_____。
A.冷水 B.浓盐酸 C.乙醇 D.氨水
②仪器 A 的名称为_____;装置 B 的作用是_____。
③以 ZnCl2H2O 为例,写出三颈烧瓶中发生反应的化学方程式_____
【答案】[Zn(OH)4]2﹣+2CO2=Zn(OH)2↓+2HCO3﹣ ABD C 干燥管 吸收尾气并防止倒吸 2ZnCl2H2O+SOCl2=2ZnCl2+2HCl+H2SO4
【解析】
(1)“调节pH”步骤中通入过量CO2时,[Zn(OH)4]2﹣与CO2反应,生成Zn(OH)2沉淀;
(2)A. 加入过量 NaOH 溶液,可使ZnO充分反应;
B. CuO、FeO与氢氧化钠溶液不反应;
C. 洗涤沉淀时,直接将洗涤液加入漏斗,不能用玻璃棒轻轻搅拌,防止滤纸破裂;
D. 利用结晶法从氯化锌溶液中获得氯化锌晶体,要注意应在氯化氢氛围中,可防止氯化锌水解;
(3)①洗涤氯化锌晶体的应避免晶体的溶解由此选择试剂;
②由装置图判断仪器名称;装置 B 为尾气吸收装置,同时还可防倒吸;
③三颈烧瓶中ZnCl2H2O与SOCl2反应,生成ZnCl2、HCl和H2SO4,据此书写方程式。
(1)“调节pH”步骤中通入过量CO2时,生成Zn(OH)2沉淀,发生反应的离子方程式为[Zn(OH)4]2﹣+2CO2=Zn(OH)2↓+2HCO3﹣;
(2)A. 加入过量 NaOH 溶液,可使ZnO充分反应,可提高锌元素的浸取率,A项正确;
B. CuO、FeO与氢氧化钠溶液不反应,因此沉淀 A 主要成分是 CuO、FeO, B项正确;
C. 洗涤沉淀时,直接将洗涤液加入漏斗,不能用玻璃棒轻轻搅拌,防止滤纸破裂,C项错误;
D. 利用结晶法从氯化锌溶液中获得氯化锌晶体,要注意应在氯化氢氛围中,可防止氯化锌水解,D项正确;
答案选ABD;
(3)①洗涤氯化锌晶体的应避免晶体的溶解,因此选择的试剂为乙醇,答案选C;
②由装置图可知A为干燥管;装置 B 为尾气吸收装置,同时还可防倒吸;
③三颈烧瓶中ZnCl2H2O与SOCl2反应,生成ZnCl2、HCl和H2SO4,反应方程式为:2ZnCl2H2O+SOCl2=2ZnCl2+2HCl+H2SO4。


科目:高中化学 来源: 题型:
【题目】根据原子结构与性质的相关知识,请回答下列问题:
(1)基态S原子电子占据最高能层的符号是___________,最高能级的电子云轮廓图为___________形。
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。

(3)Fe3+基态核外电子排布式为___________
(4)根据元素周期律,原子半径As ________Se,电负性As________ Se (填“大于”或“小于”)
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中采用废旧易拉罐(主要成分为Al,含少量Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O的过程如图所示:
![]()
下列说法不正确的是
A.试剂①可以选用NaOH溶液
B.NH4HCO3用于调节滤液A的pH
C.操作a是蒸发浓缩、冷却结晶、过滤
D.明矾溶液显酸性,常作消毒杀菌剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A. 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B. 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C.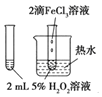 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D.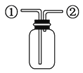 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___、___。
(2)XZ2与YZ2分子的立体构型分别是__和__,相同条件下两者在水中的溶解度较大的是___(写分子式),理由是__。
(3)Q的元素符号是__,它属于第__周期,它的核外电子排布式为__,在形成化合物时它的最高化合价为___。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题:![]() 为了配制模拟尾气,甲组同学用下图所示装置分别制备NO、乙烯及CO三袋气体。
为了配制模拟尾气,甲组同学用下图所示装置分别制备NO、乙烯及CO三袋气体。
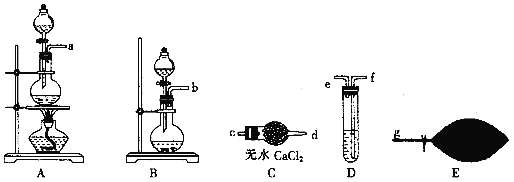
![]() 用装置A制取NO,分液漏斗中盛放的是________
用装置A制取NO,分液漏斗中盛放的是________![]() 填试剂名称
填试剂名称![]() 。
。
![]() 用
用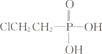
![]() 乙烯利
乙烯利![]() 与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为____
与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为____![]() 磷转化为
磷转化为![]() 。
。
![]() 用
用![]() 与浓硫酸制取
与浓硫酸制取![]() 化学方程式为
化学方程式为![]() 并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为____
并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为____![]() 气流从左至右
气流从左至右![]() ,其中装置D中盛放的药品是_______。
,其中装置D中盛放的药品是_______。
![]() 乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气
乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气![]() 、CO、
、CO、![]() 及空气
及空气![]() ,按如图所示装置进行尾气转化并检验。
,按如图所示装置进行尾气转化并检验。

![]() 为检验催化反应后的气体中是否有
为检验催化反应后的气体中是否有![]() 生成和乙烯的残留,G、H中盛放的试剂依次是_____、____
生成和乙烯的残留,G、H中盛放的试剂依次是_____、____![]() 填标号
填标号![]() 。
。
![]() 溶液
溶液 ![]() 酸性
酸性![]() 溶液
溶液 ![]() 澄清石灰水
澄清石灰水 ![]() 溶液
溶液
![]() 通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是_____;写出其中CO与NO完全转化为无害气体的化学方程式:____________
通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是_____;写出其中CO与NO完全转化为无害气体的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸![]() 足量
足量![]() 的反应,并验证
的反应,并验证![]() 的性质,设计如图所示装置进行实验,下列说法不正确的是()
的性质,设计如图所示装置进行实验,下列说法不正确的是()
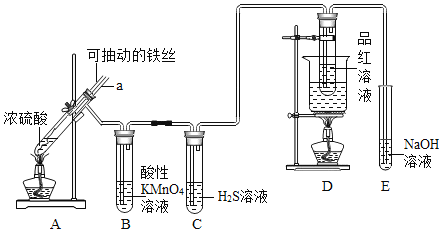
A.装置B中酸性![]() 溶液逐渐褪色,体现了二氧化硫的还原性
溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的![]()
C.装置D中品红溶液褪色可以验证![]() 的漂白性
的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知煤气化制合成气(CO 和H2)的主要反应有:
①C(s)+H2O(g)CO(g)+H2(g)△H1=131.3kJmol﹣1
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=90kJmol﹣1
(1)有利于提高上述反应①平衡转化率的条件是_____。
A.高温高压B.高温低压C.低温高压D.低温低压
(2)研究表明,将C(s)和H2O(g)置于密闭容器中发生反应①,升高温度,增大压强,氢气的含量也显著增大,理由是_____。
(3)由合成气制甲醇能发生反应:CO(g)+2H2(g)CH3OH(g)△H<0,在相同容积的 甲、乙、丙三个恒容密闭容器中分别投入amolCO和2amolH2,三个容器的反应温度分别为 T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO 的体积分数如图所示。
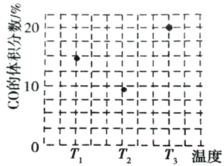
①三个容器中一定处于化学平衡状态的是_____(填“甲”“乙”或“丙”);该容器中CH3OH(g)的体积分数为_____。
②在图中分别画出反应CO(g)+2H2(g)CH3OH(g)△H<0在无催化剂、有催化剂两 种情况下“反应过程-能量”示意图_____。

(二)运用电解法,在酸性条件下可以将CO2转化为C3H8O,写出电解生成C3H8O的电极反应式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com