
| A�� | �ڢޢߢ� | B�� | �ۢܢޢ� | C�� | �ۢܢޢ� | D�� | �٢� |
���� ǿ������ʵĸ��������ǵ���̶ȣ�ֻ�в��ֵ���ĵ������������ʣ�ֻҪ֤�����Ჿ�ֵ������˵��������������ʣ����Ը�����һ��Ũ����Һ��pH����Ũ����Һ����Եȷ����жϣ�
��� �⣺�ٴ�����ˮ��������Ȼ��ܣ�˵�������ܽ���ǿ������˵�����Ჿ�ֵ��룬���Բ���˵��������������ʣ��ʴ���
�ڴ�����Һ�ܵ��磬˵�������ǵ���ʣ�������˵�����Ჿ�ֵ��룬���Բ���˵��������������ʣ��ʴ���
�۴���ϡ��Һ�д��ڴ�����ӣ�˵��������ڵ���ƽ�⣬Ϊ������ʣ�����ȷ��
�ܳ����£�0.1mol/L�����pH��0.1mol/L�����pH��˵�����Ჿ�ֵ��룬Ϊ������ʣ�����ȷ��
�ݴ����ܺ�̼��Ʒ�Ӧ�ų�CO2��˵���������Դ���̼�ᣬ������˵�����Ჿ�ֵ��룬���Բ���˵��������������ʣ��ʴ���
��0.1mol/L��������ҺpH=8.9��˵����������ǿ�������Σ�����������ᣬΪ������ʣ�����ȷ��
�ߴ�С��ͬ����Ƭ��ͬ���ʵ���Ũ�ȵ�����ʹ��ᷴӦ���������H2��������˵��������������Ũ��С�����ᣬ������ǿ�ᣬ����������ᣬ����ȷ��
��pH=a����Һ�����ʵ���Ũ�ȵ���pH=a+1����Һ�����ʵ���Ũ�ȵ�10��������˵�����Ჿ�ֵ��룬���Բ���˵��������������ʣ��ʴ���
��ѡB��
���� ���⿼��ǿ������ʵ��жϣ�Ϊ��Ƶ���㣬ǿ������ʵĸ��������ǵ���̶ȣ������ʵ��ܽ��ԡ���Һ����Զ��أ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
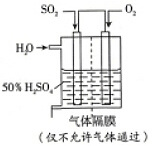 SO2�Ĵ������ǹ�ҵ����������Ĺؼ����裮
SO2�Ĵ������ǹ�ҵ����������Ĺؼ����裮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Zn2++2OH-�TZn��OH��2�� ZnCO3+2NaOH�TZn��OH��2��+Na2CO3 | |
| B�� | Ba2++SO42-�TBaSO4�� Ba��OH��2+H2SO4�TBaSO4��+2H2O | |
| C�� | Ag++Cl-�TAgCl�� AgNO3+KCl�TAgCl��+KNO3 | |
| D�� | Cu+2Ag+�TCu2++2Ag Cu+2AgCl�TCuCl2+2Ag |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������XԪ����2�� | |
| B�� | Y������������ˮ���ﲻ������ǿ�� | |
| C�� | Y���⻯���п��ܴ������Ӽ� | |
| D�� | Y�ĵ����ڳ����¿��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+�ĵ�����Ϊ10 | B�� | H218O�ķ�����Ϊ18 | ||
| C�� | Be���������1������ | D�� | H-�ĵ��Ӳ�����2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
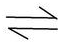 HS-+H+
HS-+H+�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com