
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
分析 A.加水稀释促进一水合氨电离,加入氯化铵固体抑制一水合氨电离;
B、pH相同、体积相同的不同一元酸与足量锌反应时,放出氢气的量与酸的物质的量成正比;
C.工业上用惰性电极电解饱和氯化钠溶液时,阳极上生成氯气,阴极上生成氢气,同时阴极附近有NaOH生成,氯气能和NaOH溶液反应;
D.两种溶度积常数表达式不同,无法比较溶度积常数大小.
解答 解:A.加水稀释促进一水合氨电离,一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(NH4+)减小,加入氯化铵固体,氯化铵能够电离出铵根离子,c(NH4+)增大,故A错误;
B、pH相同、体积相同的不同一元酸与足量锌反应时,HA放出的氢气多,说明HA的物质的量大,则HA的浓度大于HB,所以HA的酸性小于HB,故B正确;
C.工业上用惰性电极电解饱和氯化钠溶液时,阳极上生成氯气,阴极上生成氢气,同时阴极附近有NaOH生成,氯气能和NaOH溶液反应NaCl和NaClO,故C正确;
D.两种溶度积常数表达式不同,无法比较溶度积常数大小,所以根据先后沉淀确定溶度积常数错误,故D错误;
故选AD.
点评 本题考查较综合,涉及弱电解质的电离、电解原理、溶度积常数等知识点,明确物质的性质及反应原理是解本题关键,易错选项是D,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶物Ba3(PO4)2的溶度积表达式为Ksp=c(Ba2+)3•c(PO43-)2 | |
| B. | aA(g)+bB(g)?cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、容器体积保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
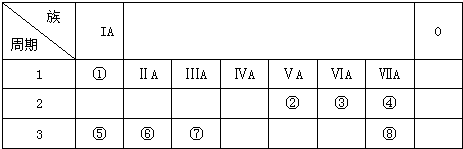
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-286 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(g)△H=-572 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-330 kJ/mol | D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 为减小酸碱中和滴定的使用误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(I)△H=-57.3kJ•mol-1,可知100mL 0.1mol•L-1的氨水混合,放出的热量等于0.573kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
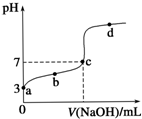 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 均等于K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com