
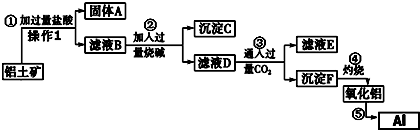
分析 铝土矿的主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质,由流程可知,加足量盐酸过滤得到沉淀A为SiO2,溶液B中含Mg2+、Al3+、Fe3+,加过量NaOH溶液过滤得到沉淀C为Fe(OH)3、Mg(OH)2,滤液D中含偏AlO2-,D中通入过量CO2后过滤得到Al(OH)3,E中含有NaCl和NaHCO3,Al(OH)3受热分解Al2O3,电解熔融Al2O3得到Al;
(1)分离难溶性固体和溶液采用过滤方法,用到的玻璃仪器除玻璃棒、烧杯外,还需漏斗;
(2)沉淀C为Fe(OH)3、Mg(OH)2;
(3)Fe3+能和KSCN溶液混合产生血红色溶液,可以用KSCN溶液检验铁离子;
(4)滤液E中的主要溶质的化学式为NaCl、NaHCO3;
(5)步骤⑤为电解熔融氧化铝.
解答 解:铝土矿的主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质,由流程可知,加足量盐酸过滤得到沉淀A为SiO2,溶液B中含Mg2+、Al3+、Fe3+,加过量NaOH溶液过滤得到沉淀C为Fe(OH)3、Mg(OH)2,滤液D中含偏AlO2-,D中通入过量CO2后过滤得到Al(OH)3,E中含有NaCl和NaHCO3,Al(OH)3受热分解Al2O3,电解熔融Al2O3得到Al;
(1)分离难溶性固体和溶液采用过滤方法,所以操作1是过滤,用到的玻璃仪器除玻璃棒、烧杯外,还需漏斗,故答案为:过滤;漏斗;
(2)沉淀C为Fe(OH)3、Mg(OH)2,故答案为:Fe(OH)3、Mg(OH)2;
(3)Fe3+能和KSCN溶液混合产生血红色溶液,可以用KSCN溶液检验铁离子,其检验方法为再向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全,
故答案为:再向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全;
(4)滤液E中的主要溶质的化学式为NaCl、NaHCO3,故答案为:NaCl、NaHCO3;
(5)步骤⑤为电解熔融氧化铝,反应方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题以元素化合物为载体考查物质分离和提纯,为高频考点,侧重考查学生分析推断及基本操作能力,明确物质性质及实验基本操作是解本题关键,知道流程图中发生的反应及操作方法,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
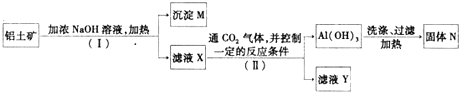
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加料方式(mol) | H2的体积分数 | ||||
| 物质 | CO(g) | H2O(g) | CO2(g) | H2(g) | |
| 加料一 | 1 | 3 | 0 | 0 | a% |
| 加料二 | 0 | 1.2 | 0.6 | 0.6 | b% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
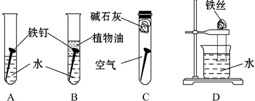 某研究性学习小组对铁生锈进行研究.
某研究性学习小组对铁生锈进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
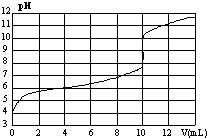 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com