
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
科目:高中化学 来源: 题型:解答题
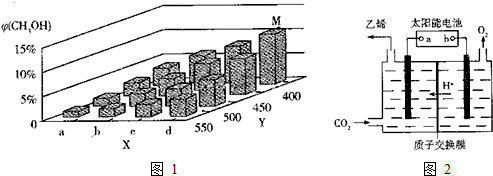
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
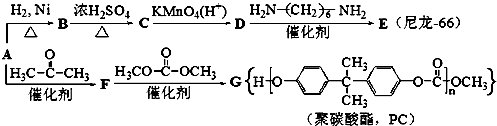
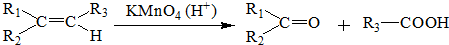
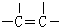 .
.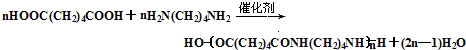 .
.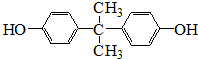 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
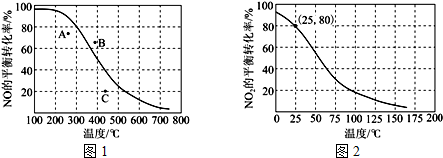
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
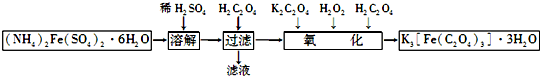
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
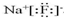 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.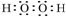 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或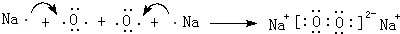 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com