
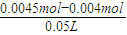 =0.01mol/L,则反应后的pH=12,故A错误;
=0.01mol/L,则反应后的pH=12,故A错误;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014届广东省惠州市高考第一次调研考试理综化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是
A.常温下,Na2CO3溶液的pH>7
B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应
C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为:
c(Cl-)=c(NH4+)>c(H+)=c(OH一)
D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,将20 mL 0.1mol?L-1H2SO4溶液和30mL 0.15mol?L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| B.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11的氨水中由水电离出的c(H+):①>③>② |
| C.常温下,0.1 mol/L HA(某酸)溶液pH≠l,则BA(盐)溶液pH一定大于7 |
| D.25℃时,pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3中c(Na+):①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知由短周期元素组成的五种常见化合物分子A、B、C、D、E,其所含原子数目依次为2、3、4、5、6,其中A、B、E各含18个电子,C、D各含10个电子。请回答:
(1)D中含有的化学键类型有 ,若实验测得在25℃、101kPa时,8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,则该反应的热化学方程式为 。
(2)室温下,向一定量C的稀溶液中逐滴加入A的稀溶液,有离子化合物XY4Z(X、Y、Z表示元素符号)生成,混合液pH变化如图所示。实验过程中,当pH=7时,下列关于混合液中离子浓度判断正确的是 。

Ⅰ. c(XY+4)>c(Z—)>c(OH—)=c(H+)
Ⅱ. c(XY+4)=c(Z—),c(OH—)=c(H+)
Ⅲ. c(Z—)>c(XY+4)> c(OH—)=c(H+)
Ⅳ. c(XY+4) + c(H+) = c(Z—) + c(OH—)
(3)XY4Z溶液PH 7(填“小于、等于、大于”),其原因用离子方程式表示为: 。
(4)将B缓慢通入Cu(OH)2悬浊液中,浑浊变为黑色,原因是 。
(5)E的核磁共振氢谱图中有两组峰,且峰覆盖的面积比为3︰1 ,E的结构式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com