
【题目】下列图中的实验,能达到实验目的的是
A | B | C | D | |
实验方案 |
|
|
|
|
实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 除去SO2中的少量HCl | 准确量取20.00mL体积K2Cr2O7标准溶液 |
A. AB. BC. CD. D
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯化铁腐蚀铜板:Fe3++Cu===Fe2++Cu2+
B. 实验室制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 稀硫酸中加氢氧化钡溶液至溶液呈中性:Ba2++H++OH-+SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
D. 用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2 ===SO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要 240mL 1 mol· L-1 的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用 的仪器有:① 胶头滴管;②玻璃棒;③烧杯;④量筒。 请回答下列问题:

(1)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(2)该硫酸的物质的量浓度为__________ mol/L;所需浓硫酸的体积约为_______mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数_______49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是_________________
(4)下列操作对 H2SO4 的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:_________________ ;
②量筒量取液体药品时仰视读数:_____________ ;
③未等溶液冷却就定容:_____________ 。
(5)在配制过程中,下列操作不正确的是(填序号) _____________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的 18.4mol·L-1 的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为,![]() ,放电工作示意图如图。下列叙述不正确的是
,放电工作示意图如图。下列叙述不正确的是

A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:![]()
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
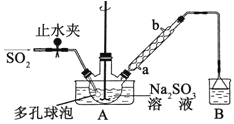
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
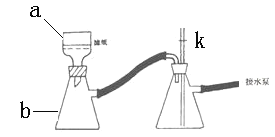
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含有_____个硫原子,_____mol O。
(2)写出下列物质在水溶液中的电离方程式
HCl:_______________NaHSO4:____________________
(3)写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式_________________
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式____________________
印刷电路板处理时铜与氯化铁溶液反应的离子方程式_______________________
(4)配平下列方程式:
_____I-+_____IO3-+ _____H+—_____I2+_____H2O
_____NH4ClO4——_____N2↑+_____O2↑+_____HCl+_____H2O
(5)用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O__________________
HNO3的作用是__________,发生氧化反应,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
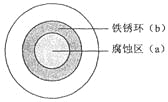
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O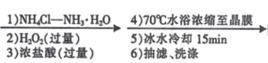 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体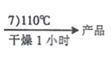
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com